جواب در میان تارنماها صفحه 13 درس 1 شیمی دهم (کیهان زادگاه الفبای هستی)
تعداد بازدید : 80.73Mپاسخ در میان تارنماها صفحه 13 شیمی دهم
-گام به گام در میان تارنماها صفحه 13 درس کیهان زادگاه الفبای هستی
-در میان تارنماها صفحه 13 درس 1
-شما در حال مشاهده جواب در میان تارنماها صفحه 13 شیمی دهم هستید. ما در تیم مای درس، پاسخنامههای کاملاً تشریحی و استاندارد را مطابق با آخرین تغییرات کتاب درسی 1404 برای شما گردآوری کردهایم. اگر به دنبال بهروزترین پاسخها برای این صفحه هستید و میخواهید بدون نیاز به اتصال به اینترنت، علاوه بر پاسخهای گام به گام، به گنجینهای از مطالب درسی دسترسی پیدا کنید، حتماً اپلیکیشن مایدرس را نصب نمایید.
📥 دانلود اپلیکیشن مایدرس
برای دسترسی آفلاین، سریع و بدون نیاز به اینترنت به گنجینهای از گامبهگامها و نمونه سوالات، اپلیکیشن را نصب کنید.
با مراجعه به منابع علمی معتبر مانند وبگاه «انجمن شیمی ایران» و وبگاه «آیوپاك» درباره دسته بندی عنصرها به روش های دیگر، اطلاعاتی جمع آوری و نتایج خود را به كلاس گزارش كنید.
دانشمندان با مطالعه بر روی عناصر متوجه شده بودند که با وجود تفاوت بین خواص عنصرها مشابهت فیزیکی و شیمیایی بین عناصر وجود دارد. تفاوتها نیز از نظم و ترتیب خاصی پیروی میکند.
طبقه بندی عناصر، با توجه به تشابه برخی از عنصرها با یک دیگر، و نظم و ترتیب موجود در تغییرات خواص آنها امکان پذیر بود.
*اولین دسته بندی توسط لاوازیه صورت گرفت. لاوازیه عناصر را به دو دسته فلز و نافلز تقسیم کرد.
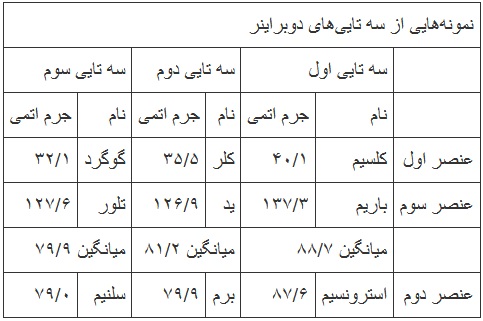
*دوبراینر دانشمند دیگری است که عناصر را در دستههای سه تایی به جدول زیر تقسیم بندی کرد.
نیوزلند براساس قانون اکتاو (گام های موسیقی) هفت عنصر را در هفت دسته هفت تایی دسته بندی کرد. در این دسته بندی خواص فیزیکی و شیمیایی در عنصر هشتم تکرار میشد.(طبق جدول زیر)

اولین دانشمندی که عناصر را طبقه بندی کرد مندلیف روسی بود. مندلیف به تغییرات خواص عناصر توجه نمود. او با بیان قانون تناوبی جدول خود را عرضه کرد.
مندلیف در تنظیم جدول دو اصل را رعایت کرد.
1- اصل تشابه خواص عناصر (قرار گرفتن عناصر با خاصیتهای مشابه در زیر هم در یک ستون)
2- افزایش تدریجی جرم اتمی عناصر در ردیف های کنار هم (تغییر تدریجی خواص)
مندلیف عناصر شناخته شده زمان خود را در چند ردیف (دوره - تناوب) براساس افزایش جرم اتمی از چپ به راست منظم نمود. به گونهای که عناصر با خواص مشابه زیر یکدیگر در یک ستون قرار بگیرند.
این کار باعث شد خانههای خالی متعددی از عناصر که در زمان مندلیف کشف نشده بود پیش بینی شود. در نتیجه قدم بزرگ در راه کشف این عناصر توسط محققین برداشته شود.
ایراد جدول مندلیف: چند مورد بی نظمی دیده میشد و آن این بود که برای رعایت اصول تشابه مجبور شد عناصر سنگینتر را قبل از عناصر سبکتر قرار دهد.
قانون تناوبی مندلیف: اگر عنصرها به ترتیب افزایش جرم اتمی در کنار هم در ردیف قرار گیرند خواص فیزیکی و شیمیایی آنها به طور تناوبی تکرار میشود.
بعد ها موزلی با کشف عدد اتمی (تعداد پروتونهای هسته) نشان داد که عدد اتمی معیار مناسب تری برای تنظیم عناصر در جدول تناوبی است. بر همین اساس موزلی معیار تنظیم عناصر در جدول را تغییر داد. به طور که در جدول تناوبی امروزی عناصر بر مبنای عدد اتمی (نه جرم اتمی) تنظیم شدهاند.
قانون تناوبی جدول امروزی: براساس کار موزلی - قانون تناوبی عناصر - هر گاه عناصر را براساس افزایش عدد اتمی در کنار یکدیگر قرار دهیم خواص فیزیکی و شیمیایی آنها به طور تناوبی تکرار میشود.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه چهارم تا دوازدهم- آزمون آنلاین تمامی دروس
- گام به گام تمامی دروس
- ویدئو های آموزشی تمامی دروس
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس
- فلش کارت های آماده دروس
- گنجینه ای جامع از انشاء های آماده
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه



1736019749.png)















