درسنامه کامل شیمی دهم
تعداد بازدید : 496.98kخلاصه نکات شیمی دهم - درسنامه شب امتحان شیمی دهم - جزوه شب امتحان شیمی دهم نوبت اول
تشکیل عناصر
فصل 1 : کیهان زادگاه الفبای هستی
تشکیل عناصر
تاکنون 118 عنصر شناخته شده است که 92 عنصر در طبیعت یافت می شود. برخی دانشمندان معتقدند که آغاز کیهان با انفجار مهیب (مهبانگ) همراه بوده که انرژی زیادی آزاد کرده و سپس ذره های زیر اتمی الکترون، نوترن و پروتون و عناصر سبک هیدروژن و هلیم و ایزوتوپ های آن به وجود آمده است. ستاره ها کارخانه تولید عناصر هستند. دما و اندازه یک ستاره نوع عناصر تشکیل شده در آن را تعیین می کند. هر چه دمای ستاره بیشتر باشد امکان، تشکیل عناصر سنگین تر مانند طلا و اورانیم فراهم می شود.
انرژی واکنش های هسته ای (برای مطالعه آزاد)
در واکنش های هسته ای ، جرم به انرژی تبدیل می شود. انیشتین رابطۀ زیر را برای این تبدیل بدست آورد.
\(E = m{c^2}\)
\(c = 3 \times {10^8}\frac{m}{s}\)
- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
ایزوتوپ ها
فصل 1 : کیهان زادگاه الفبای هستی
ایزوتوپ ها
به اتم های یک عنصر که در تعداد پروتون برابر ولی در تعداد نوترون با هم اختلاف دارند، ایزوتوپ می گویند. در هر عنصر دوکمیت A و Z که به ترتیب عدد جرمی و عدد اتمی می باشد، به صورت زیر نمایش داده می شود.
\({}_Z^AE\)= نماد همگانی
A برابر مجموع تعداد پروتون و نوترون در یک عنصر و Z تعداد پروتون است.
مثال
اتم آهن 26 الکترون، 26 پروتون، 30 نوترون دارد که به صورت: \({}_{26}^{56}Fe\)
اغلب عنصرهای طبیعی، مخلوطی از چند ایزوتوپ هستند. برای مثال یک نمونه از فلز منیزیم مخلوطی از سه ایزوتوپ می باشد.
کاربرد ایزوتوپ های پرتوزا
فصل 1 : کیهان زادگاه الفبای هستی
کاربرد ایزوتوپ های پرتوزا
برخی از ایزوتوپ ها خاصیت پرتوزایی دارند. از این خاصیت می توان سن اشیاء قدیمی و عتیقه را تخمین زد. همچنین از این ایزوتوپ ها در پزشکی هسته ای استفاده می شود. یکی از آنها تکنسیم است که به طور مصنوعی ساخته شده و در تصویر برداری غده تیروئید بکار می رود. یون یدید مشابه یون تکنسیم است و جذب غده می شود و قابل تصویر برداری است.
یک کاربرد دیگر این مواد پرتوزا در تشخیص سلول های سرطانی می باشد. با استفاده از گلوکز نشان دار می توان تومورهای سرطان زا را تشخیص داد. سلول های سرطانی فعالیت شیمیایی زیاد و سوخت و ساز بالایی دارند. در نتیجه قند بیشتری جذب کرده و پرتوزایی زیادی نشان می دهند که آنها را نشان می دهد که آشکار ساز آنها را نشان می دهد. کاربرد دیگر مواد پرتوزا در تولید برق در نیروگاه است که از عنصر اورانیوم پرتوزا استفاده می شود. مقدار فراوانی این ایزوتوپ کمتر از 7/0 درصد است که با غنی سازی ایزوتوپی جداسازی می گردد. پسماند راکتور های اتمی پرتوزا و خطرناک می باشد و هنوز قابل بازگردانی نیست و باید انبار شود.
گاز رادون: یکی از فراوان ترین مواد پرتوزا در اطراف ما است که بی رنگ، بی بو، بی مزه و سنگین است. در لایه های زیر زمین تولید می شود و به دلیل دما و فشار سطح زمین به بالا نفوذ می کند، در پزشکی کاربرد دارد.
هلیم: گاز بی بو و بی رنگ که در بالن هواشناسی، تفریحی و تبلیغاتی، در جوشکاری و کپسول غواصی، خنک کردن قطعات الکترونیکی کاربرد دارد. این گاز به علت جرم مولی بیشترش نسبت به هیدروژن، دارای رسانش و ظرفیت گرمایی بالایی است. در جهان هستی فراوان ترین عنصر بعد از هیدروژن است. این گاز از واکنش هسته ای تولید می شود و به میدان های گازی وارد می شود. 7 درصد گاز طبیعی را هلیم تشکیل می دهد و از تقطیر جز به جز گاز طبیعی جدا می شود.
طبقه بندی عناصر
فصل 1 : کیهان زادگاه الفبای هستی
طبقه بندی عناصر
گفتیم تاکنون 118 عنصر شناخته شده که در جدول زیر بر اساس افزایش عدد اتمی و خواص مشابه عناصر در یک ستون (گروه) مرتب شده اند. در این جدول به ستون عمودی گروه و ردیف افقی دوره (تناوب) می گویند. عناصر در یک گروه خواص شیمیایی مشابهی دارند.
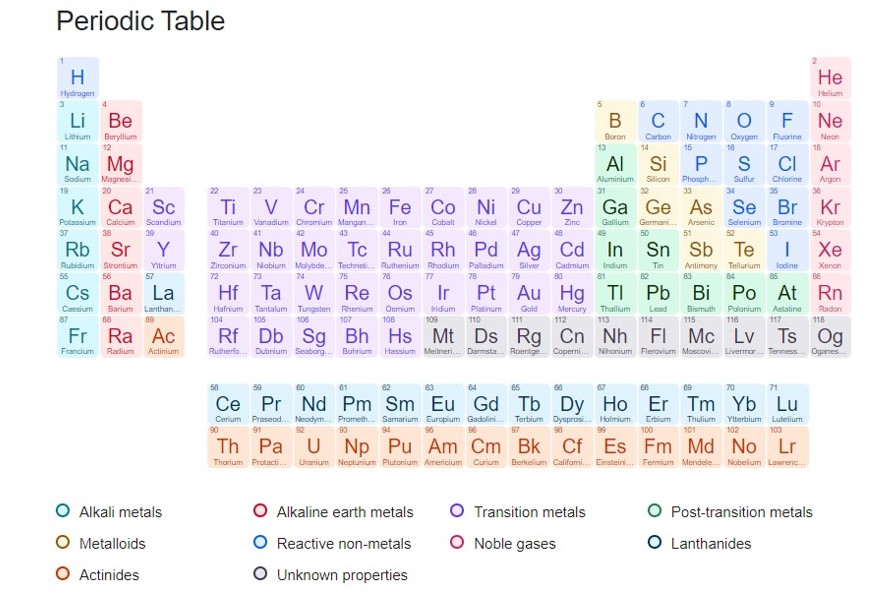
- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
محاسبه جرم اتمی
فصل 1 : کیهان زادگاه الفبای هستی
محاسبه جرم اتمی
برای محاسبه جرم اتمی از مقیاس نسبی استفاده می کنیم. مقیاس یا واحد اندازه گیری جرم \(\frac{1}{{12}}\)اتم کربن \({}_6^{12}C\) می باشد که به آن amu یا یکای جرم اتمی گویند. با تعریف جرم اتمی، دانشمندان جرم اتمی همه عناصر را نسبت به آن اندازه گیری کردند.
جرم اتمی میانگین
با توجه به اینکه در نمونه طبیعی هر عنصر ایزوتوپ های با جرم متفاوت وجود دارد، باید جرم اتمی میانگین با استفاده از فرمول زیر جرم دقیق اتم شود.محاسبه ها توسط طیف سنج جرمی اندازه شود.
جرم اتمی میانگین = \(\frac{{{m_1}{x_1} + {m_2}{x_2} + ...}}{{{x_1} + {x_2} + ...}}\)
M1 جرم اتمی ایزوتوپ 1 و M2 جرم اتمی ایزوتوپ 2
X1 درصد (تعداد) ایزوتوپ 1 و X2 درصد (تعداد) ایزوتوپ 2
شمارش اتم ها و عدد آوودگادرو
فصل 1 : کیهان زادگاه الفبای هستی
شمارش اتم ها و عدد آوودگادرو
در شیمی برای تعیین تعداد اتم ها یا مولکول ها، تعداد آن را در یک مول ذره محاسبه می کنند. در هر مول از یک ماده تعداد ذره برابر عدد \(6/022 \times {10^{23}}\) می باشد.
با استفاده از هم ارزی میان كمیت ها می توان آنها را به یكدیگر تبدیل كرد به طوری كه برای هر هم ارزی میتوان دو عامل (كسر) تبدیل نوشت. در این عامل ها، صورت و مخرج هر یک شامل عددی همراه با یكاست؛ برای نمونه از هم ارزی 100cm = 1mمی توان این دو عامل تبدیل را نوشت:
\(\frac{{1m}}{{100cm}}\) و \(\frac{{100cm}}{{1m}}\)
مثال
به عنوان مثال برای 1molC = 12/01gCمی توان دو عامل تبدیل به صورت زیر نوشت:
\(\frac{{1molC}}{{12/01gC}}\) و \(\frac{{12/01gC}}{{1molC}}\)
بنابراین برای تبدیل جرم 0/6 گرم كربن به مول های آن می توان نوشت:
\(?molC = 0/6gC \times \frac{{1molC}}{{12/01gC}} = 0/4molC\)
نور کلید شناخت جهان
فصل 1 : کیهان زادگاه الفبای هستی
نور کلید شناخت جهان
نور شکلی از انرژی است که به صورت موج منتشر می شود. با استفاده از طیف سنج می توان نور را تجزیه کرد و رنگ های مختلفی را ایجاد کرد که شامل بی نهایت موج است. چشم ما می تواند گستره رنگ های قرمز تا بنفش را ببیند که به آن طیف مرئی می گویند. طول موج نور با انرژی آن رابطه عکس دارد برای نمونه انرژی نور آبی از قرمز بیشتر است. طول موج را با \(\lambda \) نماش می دهند. از بین تمام امواج الکترو مغناطیس خورشید فقط امواج مرئی قابل دیدن است و بقیه قابل دیدن نیستند.
نشر نور و طیف نشری خطی
تجربه نشان می دهد که فلز ها و نمک فلز ها رنگ شعله را تغیر می دهند. برای مثال نمک های سدیم رنگ زرد متمایل به نارنجی، فلز مس و نمک های آن رنگ سبز، لیتیم قرمز لاکی و کلسیم قرمز آجری می باشد. وقتی یک ترکیب شیمیایی در شعله قرار گیرد طول موج های نوری که تولید می شود، طیف نشری خطی نامیده می شود. طیف نشری را به صورت خطوط عمودی روی یک نوار افقی با طول موج نمایش می دهند.
- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
کشف ساختار اتم
فصل 1 : کیهان زادگاه الفبای هستی
کشف ساختار اتم
هر خط یا نوار رنگی در طیف نشری خطی عنصر یک طول موج و انرژی معینی دارد که مطالعه تعداد و جایگاه این خط ها، اطلاعاتی را از ساختار الکترونی اتم در اختیار ما می گذارد. نیلز بور با مطالعه طیف نشری خطی اتم هیدروژن توانست یک مدل برای ساختار اتم هیدروژن ارائه کند. او هر خط طیفی را به یک انتقال الکترون بین ترازهای انرژی نسبت داد. انتقال الکترون از حالت پر انرژی تر به حالت کم انرژی تر نور منتشر می کند. هر اتم با آرایش الکترونی ویژۀ خود دارای انرژی معینی بوده و از پایداری ویژهای برخوردار است که به آن حالت پایه می گویند.
حالت برانگیخته یعنی با گرما یا تابش نور، می توان آرایش الکترونی را برای لحظه ای تغییر داد که به این شرایط اتم حالت برانگیخته می گویند.
مدل کوانتومی اتم
فصل 1 : کیهان زادگاه الفبای هستی
مدل کوانتومی اتم
برای توجیه طیف نشری عنصرها و چگونگی نشر آنها، ساختار لایه ای در نظر می گیرند. این مدل برای اتم برای اتم اطراف هسته تعدادی لایه در نظر می گیرد. شماره هر لایه را با n (عدد کوانتومی اصلی) نشان می دهند. در این مدل هسته در فضای کوچک و مرکز آن قرار دارد و الکترون در فضای بزرگ و در لایه ها توزیع می شود. الکترون ها در تمام نقاط لایه ها حضور دارند ولی احتمال حضور آنها در یک محدوده بیشتر است. در هر لایه الکترون انرژی معینی دارد و با فاصله از هسته زیاد می شود. هر چه لایه ها به آخر نزدیک می شود انرژی آنها به هم نزدیک تر می شود. با گرما یا تابش در حالت گازی، الکترون های اتم با جذب انرژی از لایه ای به لایه دیگر جابه جا می شوند و بر اثر بازگشت الکترون به لایه قبلی، تابش گسیل می شود همان طیف نشری خطی عنصر است. چون هر اتم لایه های مخصوص به خود دارد، در نتیجه طیف نشری خطی نیز ویژه همان اتم است.
طیف نشری اتم هیدروژن در ناحیه مریی، این قسمت از طیف هیدروژن در اثر بازگشت الکترون به لایه 2ا تفاق می افتد. از انتقال الکترون از لایه 6، 5، 4 و 3 به لایه 2، چهار خط طیفی با طول موج های 410، 434، 486 و 656 نانومتر ایجاد می شود. انرژی الکترون ها کوانتومی است. به این مفهوم که انرژی الکترون مقادیر معین و مشخص است و مانند پله های نردبان بین پله ها توقف ندارد، یعنی الکترون هنگام جابه جایی بین لایه ها محدودیت های مشابهی مانند پله های نردبان دارد. به این مدل، مدل کوانتومی اتم گویند.
آرایش اتمی الکترون
فصل 1 : کیهان زادگاه الفبای هستی
آرایش اتمی الکترون
اتم در اطراف هسته دارای چند لایه می باشد که تا لایه هفتم آن در عناصر جدول تناوبی پر می شود. تعداد الکترون در هر لایه مقدار مشخصی می باشد و هر لایه از چند زیر لایه تشکیل می شود. زیر لایه موارد زیر است.
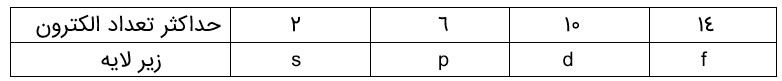
تعداد الکترون هر لایه با توجه به عدد کوانتومی n (شماره لایه(برابر \(2{n^2}\) می باشد. پر شدن الکترون در اتم طبق اصل آفبا (واژه آلمانی به معنی ساختن یا افزایش گام به گام) صورت می گیرد.
1s / 2s 2p / 3s 3p / 4s 3d 4p / 5s 4d 5p / 6s 4f 5d 6p / 7s 5f 6d 7p
انرژی زیرلایه ها به n و n+I وابسته است به طوری که اگر n+I برای دو یا چند زیر لایه یکسان باشد، زیر لایه با n بزرگتر، انرژی بیشتری دارد.
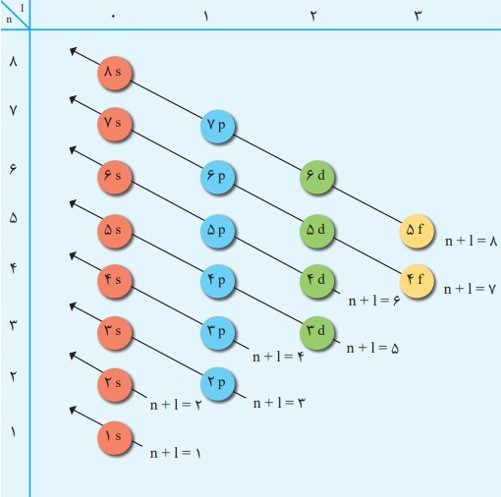
داده های طیف سنجی نشان می دهد كه آرایش الكترونی برخی اتم ها از قاعدۀ آفبا پیروی نمی كند؛ برای نمونه هر یک از اتم های كروم و مس در بیرونی ترین زیر لایۀ خود تنها یک الكترون دارد.
در رسم آرایش الکترونی به روش فشرده یا خلاصه، از یک گاز نجیب کوچک تر از عدد اتمی عنصر برای رسم آرایش الکترونی آن استفاده می شود، یعنی گاز نجیب کوچک تر را داخل کروشه نوشته و ادامه آرایش الکترونی بعد از گاز نجیب نوشته می شود. مثال:
\({}_{11}Na:[{}_{10}Ne],3{s^1}\)
اهمیت آرایش الکترونی فشرده به دلیل نمایش آرایش الكترون ها در بیرونی ترین لایه به نام لایۀ ظرفیت اتم است. لایۀ ظرفیت یک اتم، لایه ای است که الکترون های آن، رفتار شیمیایی اتم را تعیین می کند. به الکترون های این لایه، الکترون های ظرفیت اتم می گویند.
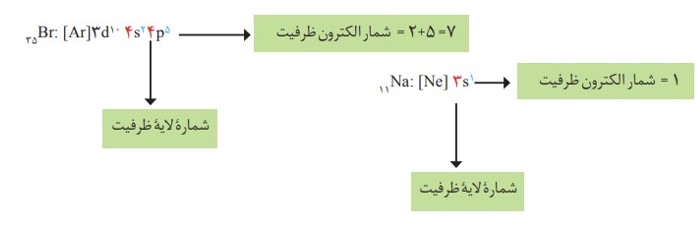
در عنصرهای دستۀ d از دورۀ چهارم، الکترون های ظرفیت شامل الکترون ها در زیرلایه های4s و d3 است.
دسته بندی عناصر
عناصر را براساس زیر لایه در حال پر شدن آنها به چهار دسته تقسیم می کنیم:
- عنصرهای دسته s که در آنها زیر لایه sدر حال پر شدن است و شامل عنصرهای گروه 1 و 2 می شود. مانند: \({}_{11}Na\) و \({}_{12}Mg\)
- عنصرهای دسته p که شامل گروه های 13 تا 18 می باشد.
- عنصرهای دسته d که شامل گروه های 3 تا 12 می باشد که عناصر واسطه نام دارد.
- عنصرهای دسته f که شامل دو ردیف 14 عنصری می باشد.
- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
ساختار اتم و رفتار آن
فصل 1 : کیهان زادگاه الفبای هستی
ساختار اتم و رفتار آن
گازهای نجیب در طبیعت به شكل تک اتمی یافت می شوند. این واقعیت بیانگر این است كه این گازها واكنش ناپذیر بوده یا واكنش پذیری بسیار كمی دارند، از این رو پایدارند.
\({}_2He:1{s^2}\)
\({}_{10}Ne:[He],2{s^2}2{p^6}\)
در لایۀ ظرفیت این اتم ها، هشت الكترون وجود دارد (به جز هلیم كه در تنها لایۀ الكترونی خود، دو الكترون دارد)؛ با این توصیف می توان نتیجه گرفت كه بین پایداری و آرایش الكترونی لایۀ ظرفیت اتم ها باید رابطه ای باشد به طوری كه اگر لایۀ ظرفیت اتمی، همانند آرایش الکترونی یک گاز نجیب بوده یا هشت تایی باشد، آن اتم واكنش پذیری چندانی ندارد؛ به دیگر سخن اگر لایۀ ظرفیت اتمی چنین نباشد، آن اتم واكنش پذیر است. لوویس برای توضیح و پیش بینی رفتار اتم ها، آرایشی به نام آرایش الكترون ــ نقطه ای ارائه کرد كه در آن الكترون های ظرفیت هر اتم، پیرامون نماد شیمیایی آن با نقطه نمایش داده می شود؛ برای نمونه، آرایش الكترون ــ نقطه ای سدیم به صورت Na. است. برای رسم آرایش الکترون ــ نقطه ای هر اتم، می توان نقطه گذاری را از یک سمت مانند سمت راست نماد شیمیایی عنصر آغاز کرد و نقطه های بعدی را در زیر، سمت چپ و بالای آن قرار داد. الکترون پنجم و پس از آن را باید طوری پیرامون نماد شیمیایی عنصر قرار داد كه هر یک به صورت جفت نقطه درآید؛
برای مثال آرایش الكترون ــ نقطه ای اتم های كربن، فسفر و آرگون به صورت زیر است:
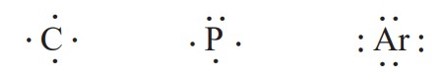
رفتار شیمیایی هر اتم به شمار الكترون های ظرفیت آن بستگی دارد به طوری كه می توان دستیابی به آرایش گاز نجیب را مبنای رفتار آنها دانست. در واقع اتم ها می توانند با دادن الكترون، گرفتن الكترون و نیز به اشتراک گذاشتن آن به آرایش یك گاز نجیب برسند یا هشت تایی شوند تا پایدارتر گردند. هرگاه اتم های سدیم و كلر كنار یكدیگر قرار گیرند، اتم سدیم با از دست دادن یک الكترون به یون سدیم و اتم كلر با گرفتن یک الكترون به یون كلرید تبدیل شده و در این واكنش سدیم كلرید (نمک خوراكی) تولید می شود.
از دسـت دادن، گـرفـتـن یـا بـه اشتراک گذاشتن الكترون نشانه ای از رفتار شیمیایی اتم است.
تبدیل اتم ها به یون ها
فصل 1 : کیهان زادگاه الفبای هستی
تبدیل اتم ها به یون ها
اتم اكسیژن برای رسیدن به آرایش گاز نجیب پس از خود باید دو الکترون بگیرد درحالی كه اتم كلسیم باید دو الكترون ظرفیت خود را از دست بدهد تا به آرایش پایدار گاز نجیب پیش از خود برسد؛ به دیگر سخن هرگاه اتم های این دو عنصر در شرایط مناسب، كنار هم قرار گیرند، با هم واكنش می دهند به طوری كه با داد و ستد الكترون به یون های \({O^{2 - }}\) و \(C{a^{2 + }}\) تبدیل می شوند. میان یون های تولید شده به دلیل وجود بارهای الکتریکی ناهمنام، نیروی جاذبۀ بسیار قوی برقرار می شود؛ نیروی جاذبه ای كه پیوند یونی نامیده می شود. تركیب حاصل از این واکنش، كلسیم اكسید نام دارد که آن را با فرمول شیمیایی CaO نشان می دهند. این فرمول شیمیایی نشان می دهد که كلسیم و اكسیژن دو عنصر سازندۀ این ترکیب اند و نسبت یون های سازندۀ آن 1 به 1 است. ترکیب هایی از این دست که ذره های سازندۀ آنها یون است، تركیب یونی نام دارند.
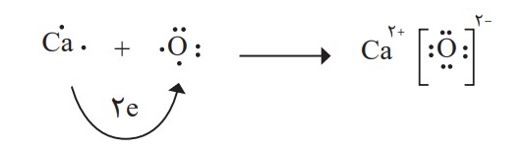
1 یون تک اتمی، كاتیون یا آنیونی است كه تنها از یک اتم تشكیل شده است؛ برای نمونه هریک از یون های \(N{a^ + }\) و \(C{l^ - }\) ، تک اتمی هستند.
2 هر تركیب یونی كه تنها از دو عنصر ساخته شده، ترکیب یونی دوتایی نامیده مـی شـود. ایـن ترکیب ها می توانند از واکنش فلزها با نافلزها پدید آیند.
3 فرمول شیمیایی کلسیم کلرید نشان می دهد که نسبت کاتیون به آنیون سازندۀ آن، 1 به 2 است.
تبدیل اتم ها به مولکول ها
فصل 1 : کیهان زادگاه الفبای هستی
تبدیل اتم ها به مولکول ها
بسیاری از تركیب های شیمیایی در ساختار خود هیچ یونی ندارند و ذره های سازندۀ آن ها مولكول ها هستند .بنابر این به آرایش الکترون _ نقطه ای اتم کلر توجه کنید.
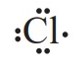
گاز كلر که خاصیت رنگ بری و گندزدایی دارد از مولكول های دو اتمی (\(C{l_2}\) ) تشكیل شده است. با توجه به آرایش الكترون ــ نقطه ای اتم كلر می توان تشكیل این مولكول را به صورت زیر نشان داد:
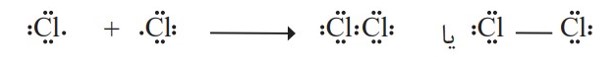
با این توصیف هر اتم كلر، تک الكترون خود را با دیگری به اشتراك می گذارد به طوری كه دو الكترون موجود بین دو اتم در آرایش الكترون ــ نقطه ای به هر دوی آنها تعلق دارد. در این وضعیت هر یک از اتم ها به آرایش هشت تایی رسیده است.
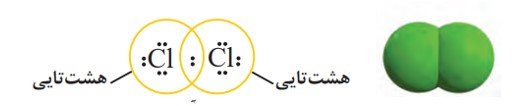
جفت الكترون اشتراكی میان دو اتم كلر در مولكول \(C{l_2}\) نشان دهندۀ یک پیوند اشتراکی (كووالانسی) است؛ پیوندی كه سبب اتصال دو اتم به یكدیگر در مولكول شده است؛ به دیگر سخن اتم نافلزها در شرایط مناسب با تشكیل پیوندهای اشتراکی می توانند مولكول های دو یا چند اتمی را بسازند.
مواد شیمیایی خالصی که در ساختـار خـود مـولـکـول دارنـد، مواد مـولکولـی نامیده می شونـد.
چگونگی تشکیل و نمایش مولکول های اکسیژن و آب
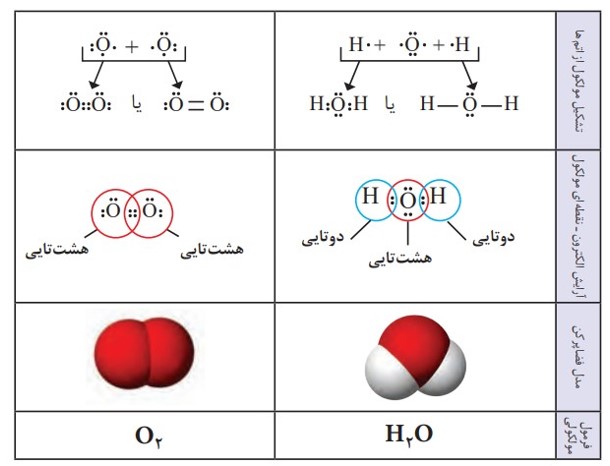
به فرمول شیمیایی که افزون بر نوع عنصرهای سازنده، شمار اتم های هر عنصر را در مولکول نشان می دهد، فرمول مولکولی می گویند.
- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
هوا کره
فصل 2 : ردِّ پای گازها در زندگی
هوا کره
زمنی در فضا همانند گویی فیروزه ای درون هاله ای از گازها با شکوه فراوان در چرخش است؛ هاله ای که سرشار از هوای پاک است؛ گرمای خورشید را در خود نگه می دارد؛ ساکنان زمین را از پرتوهای خطرناک کیهانی محافظت و آب را در سرتاسر سیارۀ ما توزیع می کند. بدین ترتیب زمین با چرخش خود، زندگی را دوام می بخشد. تداوم زندگی سالم و پایدار در این سیاره در گروِ رفتار منطقی ما با ساکنان آن است؛ رفتاری که هماهنگ و سازگار با طبیعت باشد و نظم آن را برهم نزند در میان سیاره های سامانۀ خورشیدی، تنها زمین، اتمسفری دارد که امکان زندگی را روی آن فراهم می کند. این اتمسفر، مخلوطی از گازهای گوناگون است که تا فاصله ٥٠٠ کیلومتری از سطح زمین امتداد یافته است به طوری که می توان گفت ما در کف اقیانوسی از مولکول های گازی زندگی می کنیم. جاذبۀ زمین این گازها را پیرامون خود نگه می دارد و مانع از خروج آنها از اتمسفر می شود. از سوی دیگر، انرژی گرمایی مولکول ها سبب می شود تا پیوسته آنها درحال جنبش باشند و در سرتاسر هواکره توزیع شوند. اگر زمین را به سیب تشبیه کنیم، ضخامت هواکره نسبت به زمین به نازکی پوست سیب می ماند.
اغلب گازها نامرئی هستند، به طوری که ما هوا را نمی توانیم ببینیم و به طور معمول وجود آن را در پیرامون خود حس نمی کنیم، مگر روزهایی که باد می وزد یا در مکان هایی که هوا به خوبی در جریان است. میان گازهای هوا، واکنش های شیمیایی گوناگونی رخ می دهد که اغلب آنها برای ساکنان این سیاره سودمند هستند، اما برخی از این واکنش ها مفید نبوده و فراورده هایی تولید می کنند که دلخواه و مطلوب ساکنان سیارۀ خاکی نیست.
روند تغییر فشار در هواکره
فشار هر گاز ناشی از برخورد ذره های سازنده ی گازها بر دیواره های ظرف آن است. هواکره به علت داشتن گازهای مختلف فشار دارد و این فشار در همه ی جهت ها بر بدن ما و به میزان یکسان وارد می شود. هر چه تعداد ذره های سازنده گاز در فضای مشخص افزایش یابد تعداد برخورد آن ها با دیواره ها بیش تر شده و فشار افزایش می یابد یعنی فشار یک گاز در حجم و دمای ثابت با مقدار گاز رابطه مستقیم دارد و در هواکره با افزایش ارتفاع غلظت گازها کم شده و هواکره رقیق تر می شود در نتیجه فشار در هواکره با فاصله گرفتن از سطح زمین به تدریج کاهش می یابد. لازم به ذکر است که فشار تمام لایه های هواکره با افزایش ارتفاع کم می شود.
هوا معجونی ارزشمند
فصل 2 : ردِّ پای گازها در زندگی
هوا معجونی ارزشمند
سه لایه اول یعنی تا ارتفاع 80 کیلومتری از سطح زمین از گازهای نیتروژن، اکسیژن و کربن دی اکسید تشکیل شده اند و اوزون هم در لایه ی استراتوسفر و هم در لایه ی تروپوسفر وجود دارد. بخار آب فقط در لایه ی تروپوسفر وجود دارد و بسیاری از پدیده های جوی مانند ابر، باران، برف و ... در این لایه اتفاق می افتد و به ندرت در شرایط ویژه در استراتوسفر ابر تشکیل می شود. در لایه چهارم (مزوسفر) علاوه بر گازهای \({N_2}\) و \({O_2}\) اتم اکسیژن و یون های مثبت، \({H^ + },H{e^ + },{O^ + },O_2^ + ,N_2^ + \) وجود دارند زیرا پرتوهای خورشید مولکول ها و اتم های موجود در این لایه را بمباران می کند و باعث تبدیل این ذره ها به یون مثبت و الکترون می شود. در لایه چهارم (تروموسفر) بر خلاف سه لایه دیگر (تروپوسفر، استراتوسفر و مزوسفر) اختلاط ذره های گازی به خوبی صورت می گیرد و توزیع و قرار گیری ذره های گازی در ارتفاع های مختلف بر حسب جرم مولکولی آن ها است یعنی ذره های سنگین تر در ارتفاع های پایین تر و ذره های سبک تر در ارتفاع های بالاتر قرار می گیرند. درصد حجمی گازهای تشکیل دهنده هواکره در جدول زیر آمده است.
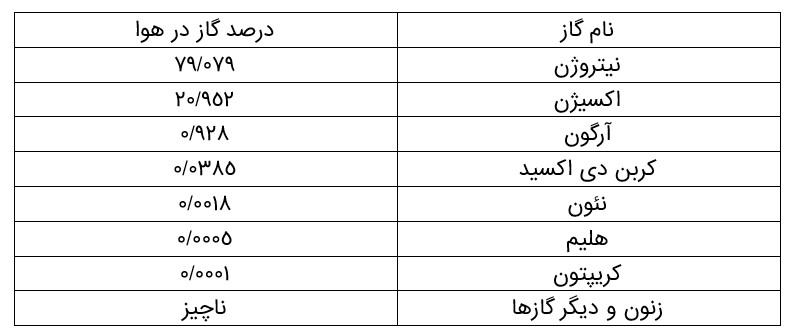
بخش عمدۀ هواكره را دو گاز نیتروژن و اكسیژن تشكیل می دهد. گاز آرگون در میان اجزای هواكره در رتبۀ سوم قرار دارد؛ بنابراین می توان هوا را منبعی غنی برای تهیۀ این گازها دانست. در صنعت، این گازها را از تقطیر جزءبه جزء هوای مایع تهیه می كنند.
در این فرایند، نخست هوا را از صافی هایی عبور می دهند تا گرد و غبار آن گرفته شود؛ سپس با استفاده از فشار، دمای هوا را پیوسته كاهش می دهند. با كاهش دمای هوا تا) \({0^0}C\) صفر درجۀ سلسیوس(، رطوبت هوا به صورت یخ از آن جدا می شود). در دمای \( - {78^0}C\) ، گاز كربن دی اكسید هوا نیز به حالت جامد در می آید. با سرد کردن بیشتر تا دمای \( - {200^0}C\) ، مخلوط بسیار سردی از چند مایع پدید می آید كه به آن هوای مایع می گویند. در پایان، با عبور هوای مایع از یك ستون تقطیر، گازهای سازنده جداسازی و در ظرف های جدا ذخیره می شوند.
آرگون گازی بی رنگ، بی بو و غیر سمی است. واژۀ آرگون به معنای تنبل است؛ زیرا واکنش پذیری ناچیزی دارد. این گاز در پتروشیمی هوای مایع شیراز از تقطیر جزء به جزء با خلوص بسیار زیاد تهیه می شود. آرگون به عنوان محیط بی اثر در جوشکاری، برش فلزها و همچنین در ساخت لامپ های رشته ای به کار می رود.
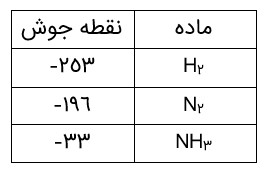
نقطه جوش بعضی از عناصر
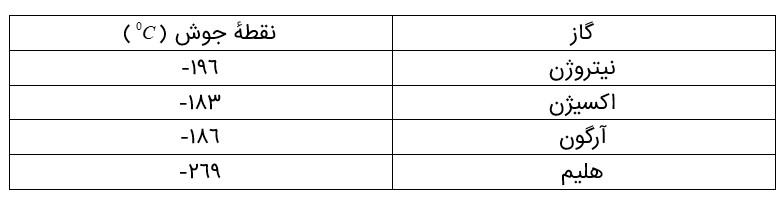
مقدار گازهای نجیب در هواكره بسیار كم است. از این رو به گازهای كمیاب نیز معروف هستند.
گاز هلیم
فصل 2 : ردِّ پای گازها در زندگی
گاز هلیم
هلیم به عنوان سبک ترین گاز نجیب، بی رنگ و بی بو است که کاربردهای فراوانی در زندگی دارد. (از هلیم، افزون بر پر کردن بالن های هواشناسی، تفریحی و تبلیغاتی در جوشکاری، کپسول غواصی و مهمتر از همه، برای خنک کردن قطعات الکترونیکی در دستگاههای تصویربرداری مانند MRI استفاده می شود.)
هلیم در کرۀ زمین به مقدار خیلی کم یافت می شود؛ به طوری که مقدار ناچیزی از آن در هوا و مقدار بیشتری در لایه های زیرین پوستۀ زمین وجود دارد؛ از این رو، منابع زمینی آن از هواکره سرشارتر و برای تولید هلیم در مقیاس صنعتی مناسب ترند. هلیم از واکنش های هسته ای در ژرفای زمین تولید می شود. این گاز پس از نفوذ به لایه های زمین، وارد میدان های گازی می شود. یافته های تجربی نشان می دهد که حدود 7 درصد حجمی از مخلوط گاز طبیعی را هلیم تشکیل می دهد. البته مقدار هلیم در میدان های گازی گوناگون، متفاوت است.
هلیم را می توان افزون بر هوای مایع، از تقطیر جزء به جزء گاز طبیعی نیز به دست آورد.
جداسازی هلیم از گاز طبیعی به دانش و فناوری پیشرفته ای نیاز دارد. و چون متخصصان ایرانی تاکنون موفق به جداسازی و تهیه آن نشده اند، کشور ما مجبور است همچنان گاز هلیم را از سایر کشور ها وارد کند.
- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
گاز اکسیژن
فصل 2 : ردِّ پای گازها در زندگی
گاز اکسیژن
ویژگی های گاز اکسیژن
- اکسیژن در گروه 16 و تناوب دوم قرار دارد.
- اکسیژن بعد از نیتروژن فراوان ترین گاز موجود در هواکره است.
- اکسیژن در هواکره عمدتاً به صورت مولکول های دو اتمی \({O_2}\) ، در آب کره به صورت مولکول های آب و در سنگ کره (پوسته زمین) به صورت ترکیب با عنصرهای دیگر می باشد.
- اکسیژن در ساختارهای همه مولکول های زیستی مانند کربوهیدرات ها، چربی ها و پروتئین ها وجود دارد.
- اکسیژن بسیار واکنش پذیر است و با اکثر عنصرها و مواد واکنش می دهد.
- اکسیژن یکی از مهم ترین گازهای تشکیل دهنده ی هواکره می باشد که زندگی روی کره ی زمین به وجود آن گره خورده است.
- با افزایش ارتفاع از سطح زمین فشار گاز هیدروژن همانند سایر گازهای هواکره کم می شود ولی درصد حجمی آن تغییر نمی کند.
- بخش قابل توجهی از واکنش های شیمیایی که روزانه پیرامون انجام می شود به دلیل وجود گاز اکسیژن در هواکره است، مانند فاسد شدن مواد غذایی، پوسیدن چوب، فرسایش سنگ و خاک، زنگ زدن وسایل آهنی و سوختن مواد سوختی و ..
- آزاد سازی انرژی شیمیایی ذخیره شده در مواد غذایی مانند چربی ها و مواد قندی در سوخت و سازهای سلولی به کمک اکسیژن انجام می شود تا انرژی برای فعالیت های بدن فراهم شود.
ترکیب اکسیژن با فلزها و نافلزها
فصل 2 : ردِّ پای گازها در زندگی
ترکیب اکسیژن با فلزها و نافلزها
اكسیژن در سنگ کره به شکل اکسیدهای گوناگون نیز یافت می شود. برای نمونه فلز آلومینیم به شکل بوکسیت (\(A{l_2}{O_3}\) به همراه ناخالصی) و سیلیسیم به شکل سیلیس (\(Si{O_2}\) ) در طبیعت وجود دارد. افزون بر فلزهایی مانند طلا و پلاتین که به حالت آزاد در طبیعت یافت می شوند، فلزهایی نیز وجود دارند که با بیش از یک نوع اکسید در طبیعت شناخته شده اند. آهن نمونه ای از آنهاست. این فلز در ترکیب با اکسیژن دو نوع اکسید با فرمولهای شیمیاییFeo ، \(F{e_2}{O_3}\) تولید می کند. واکنش عنصرها با اکسیژن، تنها به فلزها محدود نمی شود بلكه نافلزها نیز با آن واكنش می دهند و به اكسید نافلزها تبدیل می شوند. در واقع اكسیدهای نافلزی، دستۀ دیگری از تركیب های شیمیایی هستند كه از واكنش نافلزها با اكسیژن تولید می شوند. تركیبهایی مانند \(N{O_2},S{O_3},S{O_2},C{O_2}\) ، نمونه هایی از اكسیدهای نافلزی هستند. با توجه به اینكه هر زیروند در فرمول شیمیایی، نمایانگر شمار اتم های آن عنصر در تركیب است، شیمی دان ها برای بیان شمار هر یك از اتم ها، پیشوندهای معرفی شده در جدول روبه رو را به كار می برند. برای نمونه، به فرمول و نام شیمیایی تركیب زیر توجه كنید:
\({N_2}{O_4}\)
دی نیتروژن تترا اکسید
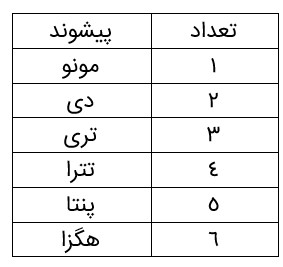
نام شیمیایی این ماده، الگویی برای نامگذاری این نوع تركیب ها است. بدین ترتیب كه نخست، شمار و نام عنصری گفته می شود كه در سمت چپ فرمول شیمیایی نوشته شده است. سپس شمار و نام عنصر دوم با پسوند (ید) بیان می شود.
اکسید ها در فرآورده های سوختن
فصل 2 : ردِّ پای گازها در زندگی
اکسید ها در فرآورده های سوختن
اكسیژن، گازی واكنش پذیر است و با اغلب عنصرها و مواد واكنش می دهد؛ به طوری که شیمیدان ها از این ویژگی برای تهیه بسیاری از مواد بهره می گیرند، برای نمونه در صنعت برای تهیه سولفوریک اسید، نخست گوگرد را در واکنش با اکسیژن به \(S{O_2}\) تبدیل می کنند. واکنشی که به سوختن گوگرد معروف است. جالب است بدانید که برخی عنصرهای فلزی و نافلزی دیگر نیز می توانند با اکسیژن بسوزند و به اکسیدهای فلزی و نافلزی تبدیل شوند. سوختن، واكنشی شیمیایی است که در آن، یک ماده با اکسیژن به سرعت واکنش می دهد و بخشی از انرژی شیمیایی آن به صورت گرما و نور آزاد می شود. افزون بر برخی عنصرها؛ دیگر مواد از جمله سوخت های فسیلی نیز در شرایط مناسب می سوزند. برای نمونه، زغال سنگ در حضور اکسیژن می سوزد و افزون بر تولید گازهای \(S{O_2}\) ، \(C{O_2}\) و بخار آب، مقدار زیادی انرژی آزاد می كند.
نور و گرما + کربن دی اکسید + گوگرد دی اکسید + بخار آب → اکسیژن + زغال سنگ
نوع فراورده ها در واكنش سوختن سوخت های فسیلی، به مقدار اكسیژن در دسترس بستگی دارد؛ به طوری كه اگر اكسیژن كافی باشد، سوختن كامل انجام می شود و گاز كربن دی اكسید و بخار آب تولید می گردد. اما اگر مقدار اكسیژن كم باشد، گاز كربن مونوكسید به همراه دیگر فراورده ها تولید خواهد شد؛ در این حالت گفته می شود سوختن ناقص است. كربن مونوكسید، گازی بی رنگ، بی بو و بسیار سمی است. چگالی این گاز كمتر از هوا و قابلیت انتشار آن در محیط بسیار زیاد است؛ به طوری كه به سرعت در همۀ فضای اتاق پخش می شود. از آنجا که میل تركیبی هموگلوبین خون با این گاز بسیار زیاد و بیش از 2۰۰ برابر اكسیژن است، مولكول های آن پس از اتصال به هموگلوبین از رسیدن اكسیژن به بافت های بدن جلوگیری می كنند. این ویژگی باعث مسمومیت می شود و سامانۀ عصبی را فلج می كند به طوری که قدرت هرگونه اقدامی را از فرد مسموم می گیرد و بدین ترتیب باعث مرگ می شود.
- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
اکسید های فلزی و نافلزی
فصل 2 : ردِّ پای گازها در زندگی
اکسید های فلزی و نافلزی
اكسیدهای فلزی و نافلزی، به دلیل تنوع رفتار، كاربردهای فراوانی در زندگی دارند. برای نمونه برخی كشاورزان كلسیم اكسید (آهك) را به عنوان اكسید فلزی برای افزایش بهره وری در كشاورزی به خاک می افزایند؛ زیرا افزودن این نوع مواد به خاک سبب می شود تا مقدار و نوع مواد معدنی در دسترس گیاه تغییر كند. همچنین از كلسیم اكسید برای كنترل میزان اسیدی بودن آب دریاچه ها استفاده می شود.
اکسیدهای فلزی را اکسید بازی و اکسیدهای نافلزی را اکسید اسیدی می نامند زیرا اکسیدهای نافلزی در آب تولید باز می کنند و PH محلول حاصل بزرگ تر از 7 می باشد و اکسیدهای نافلزی در آب تولید اسید می کنند و PH محلول حاصل کم تر از 7 می باشد.
همه اکسیدهای نافلزی با یک مولکول آب ترکیب می شوند و اسید مربوطه را تولید می کنند به جزء اکسیدهای فسفر که با شش مولکول آب ترکیب می شوند و اسید مربوطه را تولید می کنند.
واکنش های شیمیایی و قانون پایستگی جرم
فصل 2 : ردِّ پای گازها در زندگی
واکنش های شیمیایی و قانون پایستگی جرم
تغییر شیمیایی می تواند با تغییر رنگ، مزه، بو یا آزاد سازی گاز، تشکیل رسوب و گاهی ایجاد نور و صدا همراه باشد. در هر تغییر شیمیایی مانند سوخنت مواد، فساد موادغذایی و... از یك یا چند مادۀ شیمیایی، ماده (مواد) تازه ای تولید می شود. هر تغییر شیمیایی میتواند شامل یک یا چند واکنش شیمیایی باشد كه هر یك از آنها را با یك معادله نشان می دهند. در این معادله، واكنش دهنده ها در سمت چپ و فراورده ها در سمت راست نوشته می شوند؛ برای مثال، سوختن كربن را به صورت زیر نمایش می دهند:
كربن دی اكسید → اكسیژن + كربن
\(C(s) + {O_2}(g) \to C{O_2}(g)\)
معادلۀ نخست، نوشتاری و معادلۀ دوم، نمادی نامیده می شود. معادلۀ نمادی، افزون بر نمایش فرمول شیمیایی واكنش دهنده ها و فراورده ها می تواند حالت فیزیکی آنها و اطلاعاتی دربارۀ شرایط واكنش نیز ارائه کند؛ برای نمونه، معادلۀ شیمیایی زیر بیان می كند كه این واكنش در حضور كاتالیزگر پلاتین انجام می شود:
\(2{H_2}(g) + {O_2}(g) \to Pt(s) \to 2{H_2}O(l)\)
یكی از ویژگی های مهم واكنش های شیمیایی این است که همۀ آنها از قانون پایستگی جرم پیروی می كنند.
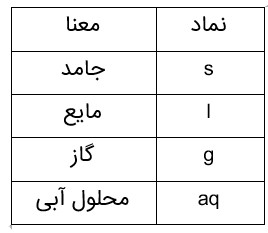
1 نمادهای به کار رفته برای نمایش حالت فیزیکی مواد در معادله های شیمیایی
2 در معادلۀ واکنش، رسوب حالت جامد، مذاب حالت مایع و بخار حالت گاز دارد.
موازنه کردن معادله واکنش های شیمیایی
فصل 2 : ردِّ پای گازها در زندگی
موازنه کردن معادله واکنش های شیمیایی
در واكنش های شیمیایی، اتمی از بین نمی رود و به وجود هم نمی آید، بلكه پس از انجام واكنش، اتم های واكنش دهنده ها به شیوه های دیگری به هم متصل می شوند و فراورده ها را به وجود می آورند. این ویژگی نشان می دهد كه جرم مواد، پیش از واكنش برابر با جرم مواد، پس از واكنش است؛ به دیگر سخن، جرم مواد شركت كننده در یك واكنش شیمیایی، ثابت است. مطابق قانون پایستگی جرم، شمار اتم های هر عنصر در یك واكنش شیمیایی ثابت است.
برای واکنش سوختن متان می توان معادله زیر را نوشت
\(C{H_4}(g) + {O_2}(g) \to C{O_2} + {H_2}O(g)\)
در این معادله، شمار اتم های كربن در واكنش دهنده ها (متان) برابر با 1 و در فراورده ها )كربن دی اكسید) نیز با 1 برابر است؛ اما شمار اتم های هیدروژن و اكسیژن در دو سوی معادله، برابر نیست. حال برای اینكه شمار اتم های این دو عنصر نیز در دو سوی معادله، برابر شود، باید به 2Oو H2O ضریب 2 داده شود؛ در این صورت، معادلۀ موازنه شده به دست می آید.
\(C{H_4}(g) + 2{O_2}(g) \to C{O_2}(g) + 2{H_2}O(g)\)
برای موازنه كردن هر معادلۀ نمادی، باید برای هر یك از واكنش دهنده ها و فراورده ها ضریبی قرارداد تا شمار اتم های هر عنصر در دو سوی معادله برابر شود.
بر اساس یکی از ساده ترین روش های موازنه (روش وارسی) اغلب به ترکیبی که دارای بیشترین شمار اتم است؛ ضریب ١ می دهند سپس با توجه به شمار اتم های این ترکیب، ضرایبی را به دیگر مواد می دهند تا شمار اتم های هر عنصر در دو سوی معادله برابر شود. برای نمونه، معادلۀ نمادی سوختن کامل پروپان به صورت زیر است: (معادله موازنه نشده است.)
\({C_3}{H_8}(g) + {O_2}(g) \to C{O_2}(g) + {H_2}O(g)\)
برای موازنه، به C3H8 ضریب ١ بدهید.
\(1{C_3}{H_8}(g) + {O_2}(g) \to C{O_2}(g) + {H_2}O(g)\)
اینک شمار اتم های کربن و هیدروژن در سمت چپ مشخص شده است. حال اگر به H2O ضریب ٤ و به 2 COضریب ٣ بدهید، شمار اتم های C و H در دو طرف برابر می شود.
\(1{C_3}{H_8}(g) + {O_2}(g) \to 3C{O_2}(g) + 4{H_2}O(g)\)
در پایان، چون شمار اتم های اکسیژن در سمت راست، تعیین شده و برابر با 10 اتم است، اگر به اکسیژن در سمت چپ، ضریب ٥ بدهید، شمار اتم های همۀ عنصرها در دو سوی معادله برابر می شوند.
\({C_3}{H_8}(g) + 5{O_2}(g) \to 3C{O_2}(g) + 4{H_2}O(g)\)
هنگام موازنه کردن، نباید زیروندها را در فرمول شیمیایی واکنش دهنده ها و فراورده ها تغییر داد. همچنین توجه به این نکته ضروری است که هریک از ضریب ها در معادلۀ موازنه شده، باید کوچکترین عدد طبیعی ممکن باشد.
برای نمونه به روش موازنۀ معادلۀ واکنش سوختن گاز هیدروژن دقت کنید. (معادله موازنه نشده است.)
\({H_2}(g) + {O_2}(g) \to {H_2}O(g)\)
در اینجا برای موازنه به H2O، ضریب ١ می دهیم.
\({H_2}(g) + {O_2}(g) \to 1{H_2}O(g)\)
حال شمار اتم های H و O در سمت راست معادله مشخص شده است. اگر به 2H ضریب ١ و به O2 ضریب\(\frac{1}{2}\) بدهیم، شمار اتم های هر دو عنصر در دو سوی معادله برابر می شود.
\(1{H_2}(g) + \frac{1}{2}{O_2}(g) \to 1{H_2}O(g)\)
در پایان برای از بین بردن ضریب کسری اکسیژن، همۀ ضریب ها را در عدد ٢ ضرب می کنیم. (معادله موازنه نشده است.)
\(2{H_2}(g) + {O_2}(g) \to 2{H_2}O(g)\)
1 معادلۀ شیمیایی موازنه شده، به دو صورت خوانده می شود؛ برای نمونه:
1 دو مول گاز هیدروژن با یک مول گاز اکسیژن واکنش می دهد و دو مول بخار آب تولید می کند.
2 دو مولکول هیدروژن با یک مولکول اکسیژن واکنش می دهد و دو مولکول آب تولید می کند.
- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
تاثیرات زندگی ما بر هواکره
فصل 2 : ردِّ پای گازها در زندگی
تاثیرات زندگی ما بر هواکره
سبک زندگی انسان، نوع وسایلی كه در زندگی استفاده می كند و رفتارهایی كه در شرایط مختلف محیطی انجام می دهد، روی هواكره تأثیر می گذارد برای مثال، نوع وسیله نقلیه ای كه برای رفتن به مدرسه، محل كار، سفر و ... استفاده می كنیم.
همه این کار ها به دلیل مصرف انرژی مقداری کربن دی اکسید وارد هواکره می کند و درصد گازهای هواكره را تغییر می دهد. در واقع سبک زندگی می تواند بیانگر میزان اثر گذاری هر یک از انسان ها بر كرۀ زمین و هواكره باشد. ردپا اصطلاحی است كه به این اثر نسبت داده اند. یكی از این ردپاها، ردپای كربن دی اكسید است. برای اینكه مقدار كربن دی اكسید در هواكره از مقدار طبیعی آن فراتر نرود، باید مقدار اضافی کربن دی اکسید به وسیلۀ گیاهان یا دیگر پدیده های طبیعی مصرف شود. حال هر چه مقدار كربن دی اكسید وارد شده به طبیعت زیادتر باشد، ردپای ایجاد شده سنگین تر و اثر آن ماندگارتر خواهد بود؛ زیرا زمان لازم برای تعدیل این اثر به وسیله پدیده های طبیعی طولانی تر است.
1 در اثر سوزاندن سوختهای فسیلی، انواع آلاینده ها وارد هوا كره می شود.
2 هوای آلوده بوی بدی دارد و چهره شهر را زشت می كند. این هوا باعث سوزش چشم، سردرد، تهوع و به وجود آمدن انواع بیماری های تنفسی مانند سرطان ریه می شود.
دانشمندان با استفاده از بالون های هواشناسی، ماهواره ها، كشتی های اقیانوس پیما و گویچه های شناور در دریاها كه به حسگرهای دما مجهز هستند، پیوسته دمای كرۀ زمین را در سرتاسر نقاط آن رصد می كنند. شواهد نشان می دهند كه در طول سدۀ گذشته میانگین دمای كرۀ زمین افزایش یافته است. این افزایش دما سبب شده تا شرایط آب و هوایی در نقاط گوناگون زمنی تغییر كند.
گاز های گلخانه ای
فصل 2 : ردِّ پای گازها در زندگی
گاز های گلخانه ای
گلخانه ها، زمین های کشاورزی ویژه ای هستند که دور تا دور آنها را تا ارتفاع معینی با لایه ای از پلاستیک های شفاف می پوشانند و در آنها گیاهان و میوه های گوناگونی پرورش می دهند. در گلخانه ها در چهارفصل سال به ویژه در زمستان، فراورده های کشاورزی مانند قارچ، خیار، گوجه فرنگی، توت فرنگی و... کشت می شود.
گلخانه، گیاه یا میوه را از آسیب های ناشی از تغییر دما و آفت ها حفظ می کند.
نور خورشید هنگام گذر از هواكره با مولكول ها و دیگر ذره های آن برخورد می كند و تنها بخشی از آن به سطح زمنی می رسد. از اینرو، زمین گرم می شود و مانند یک جسم داغ از خود پرتوهای الكترومغناطیس گسیل می دارد؛ با این تفاوت كه انرژی پرتوهای گسیل شده، كمتر و طول موج آنها بلندتر است.
کرۀ زمین با لایه ای از گازها به نام هواکره احاطه شده است. ین لایه برای زمین همانند لایۀ پلاستیکی برای گلخانه است و سبب گرم شدن کرۀ زمین می شود، به طوری که اگر این لایه وجود نداشت میانگین دمای کرۀ زمین به\( - {18^0}C\) کاهش می یافت. با این توصیف پرتوهای خورشیدی پس از برخورد به زمین دوباره با طول موج های بلندتر به هواکره بر می گردند، اما برخی گازهای موجود در هواکره مانند 2CO، H2O و... مانع از خروج آنها می شوند و بدین ترتیب زمین را گرم تر می کنند. هرچه مقدار این گازها در هواکره بیشتر باشد، دمای زمین بالاتر خواهد رفت.
شیمی سبز
فصل 2 : ردِّ پای گازها در زندگی
شیمی سبز
شیمی سبز شاخه ای از شیمی است كه در آن شیمی دان ها در جستجوی فرایندها و فراورده هایی هستند كه به كمك آن ها بتوان كیفیت زندگی را با بهره گیری از منابع طبیعی افزایش داد و همزمان از طبیعت محافظت کرد. در این راستا بایستی تولید و مصرف مواد شیمیایی را كه ردپاهای سنگینی روی كرۀ زمین برجای می گذارند، كاهش داد یا متوقف كرد.
تولید سوخت سبز
سوخت سبز، سوختی است كه در ساختار خود افزون بر كربن و هیدروژن، اكسیژن نیز دارد و از پسماندهای گیاهی مانند شاخ و برگ گیاه سویا، نیشكر و دانه های روغنی به دست می آید. این مواد زیست تخریب پذیرند، ازاین رو به وسیلۀ جانداران ذره بینی به مواد ساده تر تجزیه می شوند. اتانول و روغن های گیاهی نمونه هایی از این نوع سوخت ها هستند.
تبدیل 2COبه مواد معدنی
برای این منظور کربن دی اکسید تولید شده در نیروگاه ها و مراکز صنعتی را با منیزیم اكسید یا كلسیم اكسید واكنش می دهند.
\(C{O_2}(g) + CaO(s) \to CaC{O_3}(s)\)
\(C{O_2}(g) + MgO(s) \to MgC{O_3}(s)\)
تولید پلاستیک های سبز
پلاستیک های سبز (زیست تخریب پذیر)، پلیمرهایی هستند كه بر پایۀ مواد گیاهی مانند نشاسته ساخته می شوند و به همین دلیل در ساختار آنها اكسیژن نیز وجود دارد. این پلاستیک ها در مدت زمان نسبتاً كوتاهی تجزیه می شوند و به طبیعت باز می گردند.
دفن کردن کربن دی اکسید
کربن دی اکسید را می توان به جای رها كردن در هواكره در مكان های عمیق و امن در زیر زمین ذخیره و نگهداری كرد. سنگ های متخلخل در زیر زمین، میدان های قدیمی گاز و چاه های قدیمی نفت كه خالی از این مواد هستند، جاهای مناسبی برای دفن این گاز هستند.
توسعۀ پایدار یعنی اینكه در تولید هر فراورده، همۀ هزینه های اقتصادی، اجتماعی و زیست محیطی آن در نظر گرفته شود.
- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
اوزون، شکل دیگر اکسیژن
فصل 2 : ردِّ پای گازها در زندگی
اوزون، شکل دیگر اکسیژن
عنصر اكسیژن به شكل دیگری نیز در هواكره یافت می شود كه به اوزون شهرت دارد. اوزون، گازی با مولكول های سه اتمی در لایه های بالایی هواكره )استراتوسفر) مانند پوششی كرۀ زمین را احاطه كرده، هر چند که مقدار آن در هواكره ناچیز است.
1 مولكول های اوزون مانع ورود بخش عمده ای از تابش فرابنفش خورشید به سطح زمین می شود تا موجودات زنده از آثار زیان بار این تابش در امان بمانند.
2 اصطلاح لایۀ اوزون به منطقۀ مشخصی از استراتوسفر می گویند که بیشترین مقدار اوزون در آن محدوده قرار دارد.
دگر شكل (آلوتروپ (به هر یک از شكل های مولکولی یا بلوری یک عنصر گفته می شود.
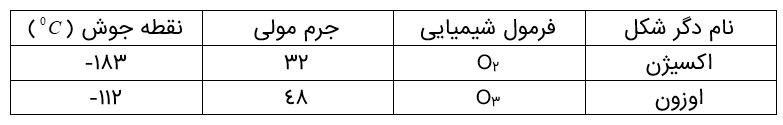
در مولكول اوزون سه پیوند اشتراکی وجود دارد. هنگامی كه تابش پرانرژی فرابنفش به این مولكول می رسد، پیوند اشتراکی بین دوتا از اتم های اكسیژن می شكند و مولكول اوزون به یك اتم اكسیژن و یک مولكول اكسیژن تبدیل می شود. ذره های تولید شده می توانند دوباره در واكنش با یكدیگر، مولكول اوزون را تولید كنند اما در این واكنش، مقداری انرژی به شکل تابش فروسرخ آزاد می شود. با تكرار پیوستۀ این دو واكنش، لایۀ اوزون بخش قابل توجهی از تابش فرابنفش را جذب می کند و تابش های كم انرژی تر فروسرخ را به زمین گسیل می دارد.
اوزون در لایۀ تروپوسفر نیز یافت می شود. از آنجا كه اوزون از اكسیژن واكنش پذیرتر است، این ماده، آلاینده ای سمی و خطرناك به شمار می آید به طوری كه وجود آن در هوایی كه تنفس می كنیم، سبب سوزش چشمان و آسیب دیدن ریه ها می شود. به دیگر سخن در تروپوسفر با نقش زیان بار و مضر اوزون مواجه هستیم در حالی كه در استراتوسفر، نقش مفید و محافظتی اوزون آشكار است.
گاز نیتروژن به عنوان اصلی ترین جزء به طور معمول با اكسیژن واكنش نمی دهد. تنها هنگام رعد و برق این دو گاز در هوا تركیب شده و به اكسیدهای نیتروژن تبدیل می شوند.
\({N_2}(g) + {O_2}(g) \to 2NO(g)\)
\(2NO(g) + {O_2}(g) \to 2N{O_2}(g)\)
در هوای آلودۀ شهرهای صنعتی و بزرگ، به مقدار قابل توجهی اكسیدهای نیتروژن وجود دارد. در واقع این گازها از واكنش گازهای نیتروژن و اكسیژن درون موتور خودرو در دمای بالا به وجود می آیند. از آنجا كه گاز نیتروژن دی اكسید به رنگ قهوه ای است، هوای آلوده کلان شهرها اغلب به رنگ قهوه ای روشن دیده می شود. در این هوای آلوده و در حضور نور خورشید، واکنش زیر رخ می دهد و مقداری گاز اوزون تولید می گردد. این اوزون، همان اوزون تروپوسفری است.
\(N{O_2}(g) + {O_2}(g) \to Sunlight \to NO(g) + {O_3}(g)\)
Sunlight به معنی نور خورشید می باشد.
برای شناخت بهتر هواكره و یافتن راه حل های مناسب برای محافظت از آن باید رفتار و ویژگی های ذره های سازندۀ هوا كره و واكنش میان آنها را به خوبی مطالعه كرد.
رفتار گاز ها
فصل 2 : ردِّ پای گازها در زندگی
رفتار گاز ها
پخش شدن بوی نان تازه، گلاب و دود اسپند در فضای خانه، نشان می دهد كه مولكول های یک مادۀ گازی در هوا منتشر شده و به یاخته های بویایی ما رسیده است. ماده به حالت گاز شكل و حجم معینی ندارد، بلكه به شكل ظرف محتوی آن درمی آید و همۀ فضای ظرف را اشغال می كند. از این رو، حجم یك نمونه گاز با حجم ظرف محتوی آن برابر است.
گاز برخلاف جامد و مایع تراكم پذیر است. به طوری كه اگر به یک نمونه گاز درون سرنگ یا سیلندری با پیستون روان، فشار وارد كنیم، گاز فشرده تر و حجم آن كمتر می شود.
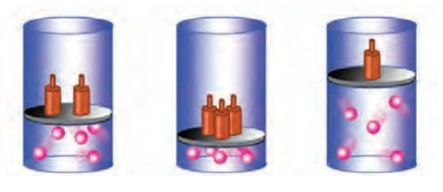
برای توصیف یک نمونه گاز افزون بر مقدار، باید دما و فشار آن نیز مشخص باشد؛ برای مثال 2/0 مول گاز اکسیژن در دما و فشار اتاق مثالی از یک نمونه گاز است.
حجم یك نمونه گاز به مقدار، دما و فشار آن وابسته است. بنابراین، با تغییر هر یک از این كمیت ها، حجم گاز تغییر می كند. برای یافتن رابطه بین حجم و مقدار یک نمونه گاز باید دما و فشار ثابت باشد. براساس قرارداد، شیمی دان ها دمای صفر درجۀ سلسیوس و فشار یک اتمسفر را به عنوان شرایط استاندارد (STP) در نظر گرفته اند.
برخی ویژگی های چند نمونه گاز در شرایط STP
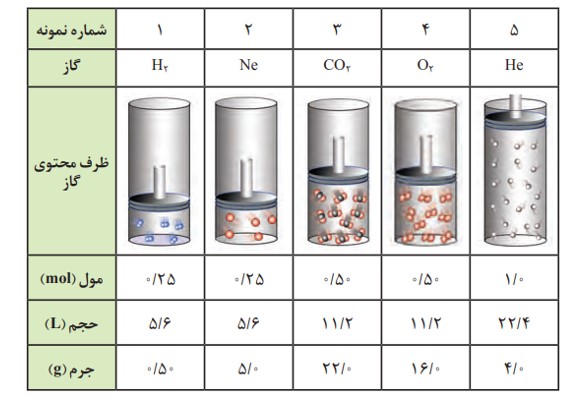
مطابق داده های جدول در این شرایط با افزایش شمار مول های هر گاز، حجم آن افزایش می یابد. از این رو حجم یک نمونه گاز با شمار مول های آن رابطه ای مستقیم دارد. طبق این رابطه حجم یك مول گاز در STP برابر با 22/4 لیتر است؛ به دیگر سخن، حجم مولی گازها در STP برابر با 22/4 لیتر است.
در دما و فشار یكسان، حجم یک مول از گازهای گوناگون با هم برابر است. این بیان نخستین بار در سال 1811 توسط آووگادرو ارائه و بعدها به قانون آووگادرو مشهور شد.
مقدار هر گاز
فصل 2 : ردِّ پای گازها در زندگی
مقدار هر گاز
واكنش گازها در صنعت، اهمیت و كاربردهای بسیاری دارد به طوری كه هر یک از فرایند های تهیۀ سولفوریك اسید و نیتریك اسید شامل چندین واكنش گازی متوالی است. یكی از این واكنش ها، تبدیل گاز گوگرد دی اكسید به گوگرد تری اكسید است.
\(2S{O_2}(g) + {O_2}(g) \to 2S{O_3}(g)\)
در معادلۀ موازنه شدۀ این واكنش، دو مول گاز گوگرد دی اكسید با یك مول گاز اكسیژن واكنش می دهد و دو مول گاز گوگرد تری اكسید تولید می شود؛ با این توصیف می توان گفت نسبت مولی اكسیژن مصرف شده به گوگرد تری اكسید تولید شده، ١ به ٢ است؛ به دیگر سخن نسبت های كمی زیر برقرار است:
\(\frac{{1mol{O_2}}}{{2molS{O_3}}},\frac{{2molS{O_3}}}{{1mol{O_2}}}\)
به هر یک از این نسبت ها یك عامل (کسر) تبدیل می گویند كه می توان با استفاده از آنها شمار مول های هر مادۀ شركت كننده در واكنش را از شمار مول های دیگری به دست آورد.
به بخشی از دانش شیمی كه به ارتباط كمی میان مواد شركت كننده (واكنش دهنده ها و فراورده ها) در هر واكنش می پردازد، استوكیومتری واكنش می گویند. دانشی كه كمک می كند تا شیمی دان ها و مهندسان در آزمایشگاه و صنعت با بهره گیری از آن، مشخص كنند كه برای تولید مقدار معینی از یک فراورده به چه مقدار از هر واكنش دهنده نیاز است.
1 به هر یک از ضرایب مواد شركت كننده در یک معادلۀ موازنه شده، ضریب استوكیومتری می گویند.
2 به واکنش آرام مواد با اکسیژن که با تولید انرژی همراه است، واکنش اکسایش می گویند.
- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
آمونیاک
فصل 2 : ردِّ پای گازها در زندگی
آمونیاک
گاز نیتروژن فراوان ترین جزء سازندۀ هوا كره بوده که در مقایسه با اكسیژن از نظر شیمیایی غیرفعال و واكنش ناپذیر است؛ برای نمونه مخلوطی از گازهای اكسیژن و هیدروژن در حضور كاتالیزگر یا جرقه در یك واكنش سریع و شدید، منفجر می شود و آب تولید می كند. اما در مخلوطی از گازهای نیتروژن و هیدروژن حتی در حضور كاتالیزگر یا جرقه، هیچ واكنشی رخ نمی دهد.
\(2{H_2}(g) + {O_2}(g) \to Catalyst \to 2{H_2}O(g)\)
Catalyst به معنی کاتالیزگر است.
\({H_2}(g) + {N_2}(g) \to Catalyst \to Nothing\)
Catalyst و Nothing به معنی کاتالیزگر و (هیچی، واکنشی رخ نداده است)، است.
از این رو گاز نیتروژن به جو بی اثر شهرت یافته و در محیط هایی كه گاز اكسیژن، عامل ایجاد تغییر شیمیایی است به جای آن از گاز نیتروژن استفاده می کنند.
هر چند گاز نیتروژن واكنش پذیری ناچیزی دارد، اما امروزه در صنعت، مواد گوناگونی از آن تهیه می كنند كه آمونیاک یكی از مهمترین آنهاست. اكنون این پرسش مطرح است كه از نیتروژن با واكنش پذیری ناچیز، چگونه شیمی دان ها آمونیاکك و تركیب های دیگر را تهیه می كنند. یافتن پاسخ این پرسش به اندازه ای اهمیت داشت كه دانشمندی به نام فریتس هابر در سال 1918 میلادی به دلیل تهیۀ آمونیاک از گازهای H2 و 2N، برندۀ جایزۀ نوبل شیمی شد. هابر واكنش زیر را مبنای پژوهش های خود قرار داد:
\(3{H_2}(g) + {N_2}(g) \to Op.Co \to 2N{H_3}(g)\)
Op.Co (Optimum condition) به معنی شرایط بهینه است.
بزرگترین چالش هابر، یافتن شرایط بهینه برای انجام این واكنش بود، به طوری که:
واكنش در دما و فشار اتاق انجام نمی شد.
هابر واكنش میان گازهای هیدروژن و نیتروژن را بارها در دماها و فشارهای گوناگون انجام داد تا بتواند شرایط بهینه آن را پیدا كند. سراجنام دریافت که اگر مخلوط این گازها از روی یک ورقۀ آهنی (کاتالیزگر) در دما و فشار مناسب عبور داده شود با انجام واكنش، مقدار قابل توجهی آمونیاک تولید می شود؛ اما همۀ واكنش دهنده ها به فراورده تبدیل نخواهد شد؛ زیرا این واكنش برگشت پذیر است؛ با این توصیف در ظرف واكنش مخلوطی از سه گاز هیدروژن، نیتروژن و آمونیاک وجود دارد. اكنون هابر با مشكل دیگری روبه رو بود:
چگونه می توان فراوردۀ واكنش (آمونیاک) را از مخلوط واكنش جدا کرد.
او با بررسی نقطۀ جوش این مواد، راه حلی را برای جداسازی آمونیاک پیدا کرد. طرح زیر، راه حل هابر را نشان می دهد.

کره زمین
فصل 3 : آب، آهنگ زندگی
کره زمین
کره ی زمین با اتمسفر یا جوی سرشار از اکسیژن و سطحی پوشیده از آب فراوان، همانند سفینه ای بسیار بزرگ و مجهز که آب و آذوقه ما را تامین می کند.
کره ی زمین در منطومه ی خورشیدی امن ترین جا برای زندگی انسان ها و دیگر جانداران و پهناورترین زیستگاه برای آبزیان است.
زمین در فضا به رنگ آبی دیده می شود زیرا نزدیک به 75% سطح آن را آب پوشیده شده است.
جرم زمین در حدود \(6 \times {10^{21}}\) تن است و جرم کل آب روی کره ی زمین در حدود \(1/5 \times {10^{18}}\) تن برآورد شده است.
بخش عمده آب موجود در کره ی زمین در اقیانوس ها و دریاها وجود دارد به طوری که اگر کره ی زمین را مسطح در نظر بگیریم آب همه ی سطح آن را تا ارتفاع 2 متر می پوشاند.
آب اقیانوس ها و دریاها مخلوطی همگن است که اغلب مزه ی شور دارند زیرا مقدار قابل توجهی از انواع نمک ها در آن حل شده است. و حدود\(1/5 \times {10^{16}}\) تن نمک در آب اقیانوس ها و دریاها وجود دارد.
جرم کل مواد حل شده در آب های کره ی زمین تقریباً ثابت است یعنی زمین از نظر شیمیایی پویا است.
کره ی زمین را می توان یک سامانه بزرگ در نظر گرفت که شامل چهار بخش هواکره، سنگ کره، آب کره و زیست کره می باشد.
پویا بودن زمین از دیدگاه شیمیایی
فصل 3 : آب، آهنگ زندگی
پویا بودن زمین از دیدگاه شیمیایی
زمین یک سامانه ای است که شامل چهار بخش هواکره، آب کره، سنگ کره و زیست کره است.
هواکره از مولکول های کوچک نیتروژن، اکسیژن و ... و آب کره از مولکول های کوچک آب و یون ها و سنگ کره از مواد جامد، ماسه، نمک ها و ... تشکیل شده است و زیست کره شامل جانداران روی کره ی زمین است که در واکنش های آن ها درشت مولکول ها نقش اساسی دارند.
بخش های کره ی زمین با یکدیگر بر هم کنش های فیزیکی و شیمیایی دارند و زمین از دیدگاه شیمیایی پویا است.
سالانه حجم زیادی از آب دریاها و اقیانوس ها بخار می شود و وارد هواکره می شوند و به صورت باران و برف در آب کره، سنگ کره و زیست کره می بارد که این بر هم کنش آب کره با سه بخش دیگر است.
جانوران آبزی سالانه میلیاردها تن گاز کربن دی اکسید را وارد هواکره می کنند و مقدار زیادی از گاز اکسیژن محلول در آب را مصرف می کنند و این بر هم کنش آب کره و زیست کره می باشد.
فعالیت های آتش فشان ها باعث می شوند گازهای گوناگون و مواد شیمیایی جامد به صورت گرد و غبار وارد هواکره می شود و این بر هم کنش سنگ کره با هواکره می باشد.
بدن جانوران و گیاهان بر اثر واکنش های شیمیایی تجزیه شده و به صورت مولکول های کوچک تری وارد آب کره و سنگ کره می شوند و هم چنین جانداران سالانه مقدار بسیار زیادی از ترکیب های کربن دار را وارد بخش های گوناگون کره ی زمین می کنند و این بر هم کنش زیست کره با آب کره، هواکره و سنگ کره می باشد.
- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
آب آهنگ زندگی
فصل 3 : آب، آهنگ زندگی
آب آهنگ زندگی
97/2% از آب های کره زمین در اقیانوس ها، 2/15% از آب ها در کوه های یخ و باقی آب های کره زمین را آب های زیر زمینی تشکیل می دهند.
بیشتر آب های روی زمین شور است و نمی توان از آنها در كشاورزی، مصارف خانگی و صنعتی استفاده كرد؛ از این رو تهیۀ آب شیرین و آشامیدنی، همچنین آب قابل استفاده در كشاورزی، صنعت و دیگر حوزه ها یكی از چالش های اساسی در سطح جهان است. از سوی دیگر اقیانوس ها، دریاها، دریاچه ها و ... منابع ارزشمندی برای تهیه و استخراج مواد شیمیایی گوناگون، تولید فراورده های پروتئینی، مواد و وسایل تزیینی، تهیۀ داروهای گوناگون و ... هستند.
آب باران در هوای پاک تقریبا خالص است، زیرا هنگام تشكیل برف و باران، تقریبا همۀ مواد حل شده در آب از آن جدا می شود. این فرایند، الگویی برای تهیۀ آب خالص است. فرایندی كه تقطیر و فراوردۀ آن آب مقطر نام دارد.
همراهان ناپیدای آب
فصل 3 : آب، آهنگ زندگی
همراهان ناپیدای آب
دریاها مخلوطی همگن از انواع یون ها و مولكول ها در آب هستند. نوع و مقدار مواد حل شده در دریاها با یكدیگر تفاوت دارند، زیرا آب هایی كه به دریاها می ریزند در مسیر خود از زمین هایی گذر می كنند كه مواد شیمیایی گوناگون دارند. اغلب چشمه ها، قنات ها و رودخانه ها، آبی زلال و شفاف دارند كه شیرین، گوارا و آشامیدنی است.
آب آشامیدنی، مخلوطی زلال و همگن بوده که حاوی مقدار كمی از یون های گوناگون است. برخی از این یون ها به طور طبیعی در آب حل شده و برخی دیگر در مراكز تأمنی آب آشامیدنی سالم به آن افزوده می شود. برای نمونه به آب آشامیدنی، مقدار بسیار کم و مناسب یون فلوئورید می افزایند زیرا وجود این یون سبب حفظ سلامت دندان ها می شود.
1 در برخی از آب های آشامیدنی مقدار یون های حل شده به قدری زیاد است كه مزۀ آب را تغییر می دهد.
2 تفاوت آب آشامیدنی و دیگر آب ها در نوع و مقدار حل شونده های آنها است.
برخی از یونهای موجود در آب آشامیدنی، مانند \({F^ - },N{a^ + },C{l^ - },C{a^{2 + }}\) تک اتمی هستند، درحالی كه برخی دیگر مانند یون نیترات (\(No_3^ - \) ) و یون سولفات (\(SO_4^{2 - }\) ) از چند اتم تشكیل شده اند. این یون ها را یون های چند اتمی می نامند. پتاسیم سولفات، تركیبی یونی است كه هر واحد آن شامل دو یون تك اتمی پتاسیم و یك یون چند امتی سولفات است.
یونی که از اتصال دو یا چند اتم تشکیل شده است، یون چند اتمی نام دارد.
برای نوشتن فرمول شیمیایی این تركیب ها، نخست نماد كاتیون را سمت چپ و فرمول شیمیایی آنیون را در سمت راست می نویسند. با توجه به اینكه یك تركیب یونی خنثی است، بر این اساس شمار كاتیون ها و آنیون ها را مشخص می كنند و به صورت زیروند در سمت راست هر یون قرار می دهند.
محلول و حل شونده ها
فصل 3 : آب، آهنگ زندگی
محلول و حل شونده ها
محلول مخلوطی همگن از دو یا چند ماده بوده که حالت فیزیکی و ترکیب شیمیایی در سرتاسر آن یکسان و یکنواخت است. محلول ها كاربردهای فراوانی در زندگی ما دارند برخی محلول ها مانند سرم فیزیولوژی رقیق و برخی مانند گلاب دو آتشه غلیظ هستند. هنگامی كه گفته می شود محلولی غلیظ است یعنی مقدار (حل شونده ها) در آن زیاد است.
مقدار نمك های حل شده در آب دریاهای گوناگون نیز با هم تفاوت دارد. برای نمونه در هر 100 گرم از آب دریای مرده (بحرالمیت)، حدود 27 گرم حل شونده (انواع نمک ها) وجود دارد؛ از این رو آب این دریا محلول غلیظی است كه انسان می تواند به راحتی روی آن شناور بماند. دریاچۀ ارومیه نیز یكی از دریاچه های شور دنیاست كه مقدار نمك های حل شده در آن بسیار زیاد است. محلول آبی این دریاچه نیز بسیار غلیظ است؛ از این رو دریاچۀ ارومیه منبع غنی از مواد شیمیایی گوناگون به شمار می آید.
هر محلول از دو جزء، حلال و حل شونده تشكیل شده است. درواقع، حلال جزئی از محلول است که حل شونده را در خود حل می کند و شمار مول های آن بیشتر است. خواص محلول ها به خواص حلال، حل شونده و مقدار هر یك از آنها بستگی دارد. بنابراین دانستن اینكه چه مقدار حل شونده در یك محلول وجود دارد، می تواند به درك خواص، رفتار و كاربرد آن محلول كمك کند. شیمی دان ها غلظت یك محلول را مقدار حل شونده در مقدار معینی از حلال یا محلول تعریف می كنند. آنها در آزمایشگاه با محلول های گوناگونی سروكار دارند كه مقدار حل شونده در آنها در گستره ای از مقدار بسیار كم تا مقدار بسیار زیاد متغیر است. از این رو غلظت محلول ها را به روش های گوناگون بیان می كنند.
- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
قسمت در میلیون
فصل 3 : آب، آهنگ زندگی
قسمت در میلیون
هرگاه 0/5 گرم مس (II) سولفات را در 99/5 گرم آب حل كنید، محلولی زیبا به رنگ آبی به دست می آید. حال اگر این محلول را با افزودن آب، چندین مرتبه رقیق تر کنیم، محلولی بسیار كم رنگ پدید می آید كه گویی رنگ ندارد. ظاهر بی رنگ آن نشان می دهد كه محلول بسیار رقیق بوده و مقدار حل شونده در آن بسیار كم است برای بیان ساده تر غلظت محلول های بسیار رقیق مانند غلظت کاتیون ها و آنیون ها در آب معدنی، آب آشامیدنی، آب دریا، بدن جانداران، بافت های گیاهی و مقدار آلاینده های هوا از كمیتی به نام قسمت در میلیون (ppm) استفاده می شود. این كمیت نشان می دهد كه در یك میلیون گرم از محلول، چند گرم حل شونده وجود دارد.
ppm از رابطۀ زیر به دست می آید:
\(ppm = \frac{{m(r)}}{{m(s)}} \times {10^6}\)
m(r) به معنای جرم حل شونده است.
m(s) به معنای جرم محلول است.
مثال
در یك نمونه آب آشامیدنی به جرم 2٠٠ گرم، 0/05 میلی گرم یون فلوئورید وجود دارد غلظت یون \(F{e^ - }\) در این نمونه چند ppm است؟
ppm = شونده حل جرممحلول / جرم × 106 = \(\frac{{5 \times {{10}^{ - 5}}g}}{{200g}} \times {10^6} = 0/25ppm\)
1 توجه کنید در این رابطه، یكای جرم در صورت و مخرج كسر باید یكسان باشد.
2 درصد جرمی را با نماد %W/W نشان می دهند كه هم ارز با شمار قسمت های حل شونده در 100 قسمت از محلول است.
مواد شیمیایی موجود در آب دریا را می توان به روش های فیزیكی یا شیمیایی از آن جدا كرد. برای نمونه سالانه میلیون ها تن سدیم كلرید با روش تبلور از آب دریا جداسازی و استخراج می شود.
جداسازی حل شونده از محلول به شکل بلورهای جامد را تبلور می نامند.
فلز منیزیم مادۀ ارزشمند دیگری است كه در تهیۀ آلیاژها، شربت معده و ... كاربرد دارد. یكی از منابع تهیۀ این فلز آب دریاست. منیزیم در آب دریا به شکل (aq)\(M{g^{2 + }}\) وجود دارد. برای استخراج و جداسازی آن، در مرحلۀ نخست منیزیم را به صورت ماده جامد و نامحلول\(Mg{(OH)_2}\) رسوب می دهند، سپس آن را به منیزیم كلرید تبدیل می كنند. در پایان با استفاده از جریان برق، منیزیم كلرید مذاب را به عنصرهای سازندۀ آن تجزیه می كنند.
\(MgCl{}_2(l) \to Mg(l) + C{l_2}(g)\)
غلظت مولی
فصل 3 : آب، آهنگ زندگی
غلظت مولی
غلظت بسیاری از محلول ها در صنعت، پزشکی، داروسازی، کشاورزی و زندگی روزانه با درصد جرمی بیان می شود، برای نمونه سرکۀ خوراکی با خاصیت اسیدی ملایم که به عنوان چاشنی در غذاها مصرف می شود، محلول ٥ درصد جرمی استیک اسید در آب است. همچنین محلول غلیظ نیتریک اسید در صنعت با غلظت ٧٠ درصد جرمی تولید و بسته به کاربرد آن، به محلول های رقیق تر تبدیل می شود. با این توصیف نباید چنین تصور شود که تهیۀ محلول ها به حالت مایع، با درصد جرمی معنی کار آسانی است. تجربه نشان می دهد که اندازه گیری حجم یک مایع به ویژه در آزمایشگاه، آسان تر از جرم آن است از سوی دیگر شیمی دان ها مقدار ماده را برحسب مول بیان می کنند در واقع مبنای محاسبه های کمی در شیمی، مول است. اینک چنین به نظر می رسد بیان غلظتی از محلول پرکاربرد تر خواهد بود که با مول های مادۀ حل شونده و حجم محلول ارتباط داشته باشد. چنین غلظتی را غلظت مولی (مولار) می نامند.
1 هنگام بیماری، توازن غلظت برخی گونه ها در خون به هم می خورد. از این رو انجام آزمایش های پزشکی و تعیین غلظت گونه های موجود در خون و دیگر محلول های بدن از ضروری ترین کارها در مراکز درمانی برای رسیدگی به یک بیمار است.
2 محلول مولار سدیم هیدروکسید نشان می دهد که در هر لیتر از این محلول، 1mol سدیم هیدروکسید حل شده است. از این رو در 0/1 لیتر از این محلول، 0/1 مول و در 10 لیتر از آن، 10 مول سدیم هیدروکسید حل شده وجود دارد.
مثال
برای تهیۀ 250 mL محلول پتاسیم یدید 0/2 مول بر لیتر )مولار( به چند مول حل شونده نیاز است؟
روش اول:
غلظت مولی = شونده حل های مولمحلول / حجم = \(\frac{{n(mol)}}{{V(L)}}\)
\(0/2mol{L^{^{ - 1}}} = \frac{{n(KI)}}{{0/25L}} \to n = 0/2mol{L^{ - 1}} \times 0/25L = 0/05mol\)
روش دوم:
محلول 0/2 مولار پتاسیم یدید نشان می دهد که در هر لیتر از محلول آن 0/2 مول KI حل شده است که از آن می توان به عامل تبدیل \(\frac{{0/2molKI}}{{1LKI(aq)}}\) دست یافت.
\(?molKI = 0/25LKI(aq) \times \frac{{0/2molKI}}{{1LKI(aq)}} = 0/05molKI\)
حلال نمک در آب
فصل 3 : آب، آهنگ زندگی
حلال نمک در آب
آمارها نشان می دهند که نزدیک به 3 درصد از جمعیت کشورمان سنگ کلیه دارند. این بیماری افزون بر زمینۀ ژن شناختی می تواند به دلیل تغذیۀ نامناسب، کم تحرکی، مصرف بیش از حد نمک خوراکی، نوشیدن کم آب، مصرف پروتئین حیوانی و لبنیات و نیز اختلالات هورمونی ایجاد شود. آیا بین میزان حل شدن نمک ها در آب و تشکیل سنگ کلیه رابطه ای وجود دارد؟ برای پاسخ به این پرسش، دانستن و درک مفهوم انحلال پذیری ضروری است. شیمی دان ها بیشترین مقدار از یک حل شونده را که در 100 گرم حلال و دمای معنی حل می شود، انحلال پذیری آن ماده می نامند. در این عبارت، واژۀ (بیشترین) نشان دهندۀ رسیدن محلول به حالت سیرشده است، محلولی که نمی تواند حل شوندۀ بیشتری را در خود حل کند.
جدول انحلال پذیری برخی مواد در آب در دمای (\({25^0}C\) ) را نشان می دهد.
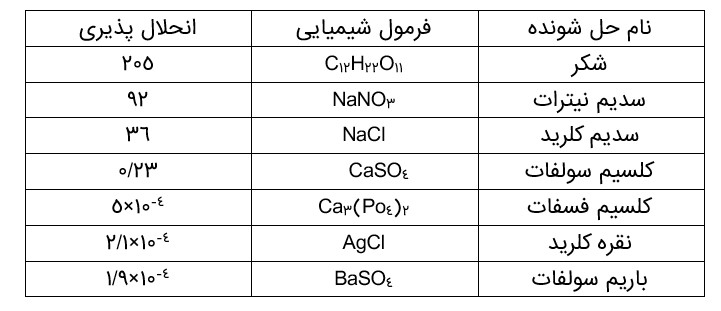
جدول نشان می دهد که در (\({25^0}C\) ) در 100g آب، هر مقدار کمتری از 36g سدیمکلرید می تواند در آب حل شود، اما یک محلول سیر نشده پدید می آید. در حالی که در این دما، حداکثر 36g سدیمکلرید می تواند در 100g آب حل شود تا 136g محلول سیر شده به دست آید. بدیهی است که در این دما برای تهیۀ محلول سیر شده ای از کلسیم سولفات باید 0/23g از آن را در 100g آب حل نمود.
انحلال پذیری نمک ها به نوع آنها و دما بستگی دارد اما تأثیر دما بر میزان انحلال پذیری آنها یکسان نیست به طوری که انحلال پذیری برخی نمک ها با افزایش دما، افزایش یافته و برخی دیگر کاهش می یابد.
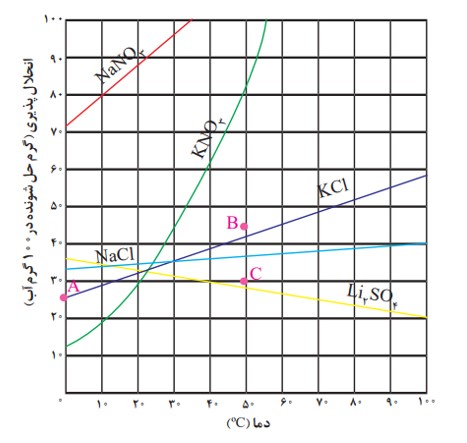
نمودار (انحلال پذیری ــ دما) نامیده می شود که برای هر نمک براساس آزمایش و از داده های تجربی آن به دست آمده است. مطابق این نمودار با افزایش دما، انحلال پذیری اغلب نمک ها افزایش می یابد.
- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
رفتار آب و سایر مولکول ها در میدان الکتریکی
فصل 3 : آب، آهنگ زندگی
رفتار آب و سایر مولکول ها در میدان الکتریکی
آب تنها ماده ای است که به هر سه حالت جامد، مایع و گاز (بخار) در طبیعت یافت می شود. وجود و تبدیل این حالت ها به یکدیگر زندگی را در سیارۀ آبی ممکن و دلپذیر ساخته است. آب ویژگی های گوناگون و شگفت انگیزی دارد. از جملۀ آنها توانایی حل کردن اغلب مواد، افزایش حجم هنگام انجماد و داشتن نقطۀجوش بالا و غیر عادی است.
با آزمایش انحراف باریکۀ آب به وسیلۀ شانه یا میلۀ شیشه ای مالش داده شده به موهای خشک آشنا هستید آزمایشی که در آن باریکۀ آب از راستای طبیعی خود منحرف می شود. میلۀ شیشه ای از لحاظ بار الکتریکی خنثی است، اما بر اثر مالش به موی خشک، دارای بار الکتریکی منفی خواهد شد. در این شرایط مولکول های آب به سوی آن جذب می شوند.
این رفتار مولکول های آب از ویژگی های ساختاری آن سرچشمه می گیرد. شکل مولکول آب خمیده V) شکل( بوده و در آن هر اتم هیدروژن با یک پیوند اشتراکی یگانه به اتم مرکزی )اکسیژن) متصل است. نوع اتم های سازنده و ساختار خمیدۀ مولکول آب، نقش تعیین کننده ای در خواص آن دارد. هنگامی که این مولکول ها در یک میدان الکتریکی قرار می گیرند، جهت گیری می کنند.
شکل زیر جهت گیری مولکول های آب در میدان الکتریکی را نشان می دهد.
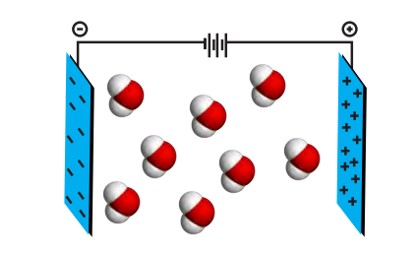
نحوۀ جهت گیری مولکول های آب در میدان الکتریکی نشان می دهد که اتم اکسیژن، سر منفی و اتم های هیدروژن، سر مثبت مولکول را تشکیل می دهند. شیمی دان ها به مولکول هایی مانند آب که در میدان الکتریکی جه تگیری می کنند، مولکول های دوقطبی یا قطبی می گویند. این درحالی است که مولکول های سازندۀ ترکیب هایی مانند گاز اکسیژن (O2)، کربن دی اکسید (CO2) و متان (CH4)در میدان الکتریکی جهت گیری نمی کنند. چنین مولکول هایی، ناقطبی نامیده می شوند.
نیرو های بین مولکولی
فصل 3 : آب، آهنگ زندگی
نیرو های بین مولکولی
نیروهای بین مولکولی در تعیین حالت فیزیکی و خواص یک ترکیب نقش مهمی دارند. گازها، دارای مولکول های مجزا با کمترین برهم کنش ها هستند. اما برهم کنش مولکول ها در مایع ها بیشتر است و در جامدها، برهم کنش ها میان مولکول ها می تواند به بیشترین مقدار ممکن برسد. از این رو در شرایط یکسان، نیروهای بین مولکولی در حالت جامد قوی تر از حالت مایع و آن هم به مراتب قوی تر از حالت گازی است. البته باید توجه داشت که نیروهای بین مولکولی به طور عمده به میزان قطبی بودن مولکول ها و جرم آنها وابسته است.
به برهم کن شهای میان مولکول های سازندۀ یک ماده، نیروهای بین مولکولی می گویند؛ نیروهایی که ذره های سازندۀ گاز به یکدیگر وارد می کنند یا نیروهایی که مولکول های مواد به حالت مایع و جامد را در کنار یکدیگر نگه می دارند.
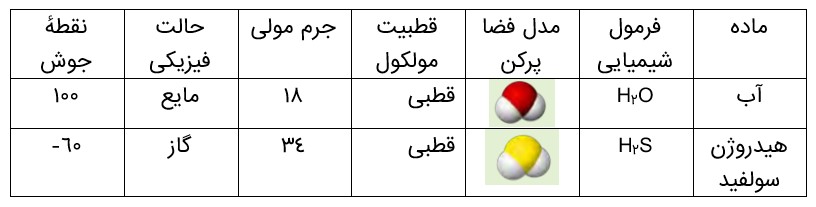
مطابق جدول، هر دو ماده مولکول های خمیده و قطبی دارند، اما آب با جرم مولی نزدیک به نصف جرم مولی هیدروژن سولفید، دمای جوش غیرعادی و بالاتری از آن دارد به طوری که تفاوتی برابر با \({160^0}C\) را نشان می دهد. گویی نیروی جاذبه میان مولکول های آب از آنچه انتظار می رود، قویتر است.
با جهت گیری مولکول های قطبی یک ماده در میدان الکتریکی آشنا شدید. این ویژگی مبنای اندازه گیری کمیتی به نام گشتاور دوقطبی است؛ کمیتی تجربی که با افزایش میزان قطبیت مولکول ها، افزایش می یابد. برای نمونه گشتاور دوقطبی مولکول هایی مانند 2O، 2COو 4CHبرابر با صفر است، در حالی که گشتاور دوقطبی مولکولهای H2O و H2S به ترتیب برابر با 1/85D و 0/97D است. این کمیت ها نشان می دهند که میزان قطبیت مولکول های آب و قدرت نیروهای بین مولکولی آن نزدیک به دو برابر مولکول های هیدروژن سولفید است. از این رو نیروهای جاذبه میان مولکولهای H2O به اندازه ای قوی است که در شرایط اتاق می تواند این مولکول ها را کنار یکدیگر نگه دارد و آب به حالت مایع باشد.
گشتاور دوقطبی (\(\mu \) ) مولکول ها را با یکای دبای (D) گزارش می کنند.
از آنجا که بارهای الکتریکی ناهمنام یکدیگر را می ربایند، در یک نمونه آب که دارای شمار بسیاری مولکول H2O است، سرمثبت هر مولکول، سرمنفی مولکول همسایه را جذب می کند. از این رو در مجموعه ای از مولکول های آب، هر اتم هیدروژن با یک نیروی جاذبۀ قوی از سوی اتم اکسیژن درمولکول همسایه جذب می شود. این نیروهای جاذبۀ قوی میان مولکول های آب که در آن هیدروژن نقش کلیدی ایفا می کند، پیوندهای هیدروژنی نامیده می شود.
به جز پیوندهای هیدروژنی، به نیروهای جاذبه بین مولکولی، نیروهای واندروالس می گویند.
شکل های آب و پیوند های هیدروژنی
فصل 3 : آب، آهنگ زندگی
شکل های آب و پیوند های هیدروژنی
آب را در سه حالت فیزیکی جامد (یخ)، مایع و بخار در نظر بگیرید. مولکول های H2O در حالت بخار جدا از هم هستند، گویی پیوندهای هیدروژنی میان آنها وجود ندارد. در این حالت، مولکول های آب آزادانه و نامنظم از جایی به جای دیگر انتقال می یابند. در حالت مایع، با اینکه مولکول ها با یکدیگر پیوندهای هیدروژنی قوی دارند، اما روی هم می لغزند و جابه جا می شوند. برخلاف آب، ساختار یخ منظم است. در یخ، مولکول های آب در جاهای به نسبت ثابتی قرار دارند. درواقع در ساختار یخ، هر اتم اکسیژن به دو اتم هیدروژن با پیوند اشتراکی و به دو اتم هیدروژن دیگر با پیوند هیدروژنی متصل است.
در ساختار یخ، آرایش مولکول های آب به گونه ای است که در آن، اتم های اکسیژن در رأس حلقه های شش ضلعی قرار دارند و شبکه ای مانند کندوی زنبور عسل را به وجود می آورند. این شبکه با داشتن فضاهای خالی منظم، در سه بعد گسترش یافته است. شکل های زیبا و متنوع دانه های برف ناشی از وجود این حلقه های شش ضلعی است.
- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
آب و سایر حلال ها
فصل 3 : آب، آهنگ زندگی
آب و سایر حلال ها
آب فراوان ترین و رایج ترین حلال در طبیعت، صنعت و آزمایشگاه است، زیرا می تواند بسیاری از ترکیب های یونی و مواد مولکولی را در خود حل کند. آب و محلول های آبی در زندگی جانداران نقش حیاتی دارند. اما همۀ محلول ها آبی نیستند زیرا افزون بر آب، حلال های دیگری نیز وجود دارند. جدول زیر سه ترکیب آلی را نشان می دهد که به عنوان حلال به کار می روند.
سه حلال آلی و برخی ویژگی های آن ها
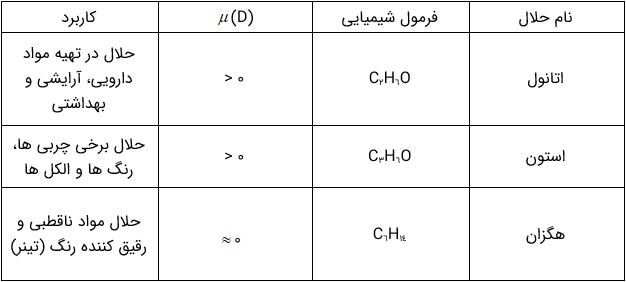
به محلول هایی که حلال آنها آلی است، محلول های غیر آبی می گویند.
1 هوا و آب دریا از جمله محلول هایی هستند که از یک حلال و چند حل شونده تشکیل شده اند.
2 برخی مواد شیمیایی مانند اتانول )الکل معمولی) و استون به هر نسبتی در آب حل می شوند. از این رو نمی توان محلول سیرشده ای از آنها تهیه کرد.
3 گشتاور دو قطبی اغلب هیدروکربن ها ناچیز و در حدود صفر است.
مواد محلول ساز
فصل 3 : آب، آهنگ زندگی
مواد محلول ساز
برخی حل شونده ها در برخی حلال ها حل می شوند و محلول تشکیل می دهند، در حالی که برخی دیگر مخلوط ناهمگن می سازند. برای نمونه، افزودن استون به آب یا اندکی یُد به هگزان منجر به تشکیل محلول می شود؛ اما، افزودن هگزان به آب، مخلوطی ناهمگن پدید می آورد.
اگر مولکول های حلال را با A و ذره های حل شونده را با B نمایش دهیم، می توان نیروهای جاذبه میان آن ها را در حالت خالص باA…..A و B…..Bنشان داد. با این توصیف برای محلول B در A رابطه زیر برقرار است.
\((A....B) > \frac{{(A....A) + (B....B)}}{2}\)
فرایند انحلال نمک ها در آب
فصل 3 : آب، آهنگ زندگی
فرایند انحلال نمک ها در آب
با انحلال مولکولی آشنا شدید. انحلالی که در آن مولکول های حل شونده، ماهیت خود را در محلول حفظ می کنند، گویی ساختار مولکول های حل شونده در محلول دچار تغییر نشده است. انحلال استون یا اتانول در آب و نیز انحلال یُد در هگزان از این نوع هستند. اما همۀ فرایندهای انحلال چنین نیستند، برای نمونه به فرایند انحلال سدیم کلرید در آب توجه کنید.
سدیم کلرید یک ترکیب یونی با بلورهای مکعبی است که در آن یون های Na+ و Cl- با آرایشی منظم در سه بعد جای گرفته اند. هنگامی که بلور کوچکی از این مادۀ جامد در آب وارد می شود، مولکول های قطبی آب از سرهای مخالف به یون های بیرونی بلور نزدیک شده، نیروی جاذبه ای میان آنها برقرار می شود. این نیروی جاذبه، یون ــ دوقطبی نام دارد؛ نیروی جاذبه ای که باعث جدا شدن یون ها از شبکه شده تا با لایه ای از مولکول های آب، پوشیده شوند. این یون های آب پوشیده در سر تا سر محلول پراکنده خواهند شد، به طوری که محلول آب نمک را می توان محلولی محتوی یون های Na+(aq) و Cl-(aq) دانست. در این فرایند انحلال، مادۀ حل شونده ویژگی ساختاری خود را حفظ نکرده است و یون های سازندۀ شبکۀ بلور یونی، تفکیک و آب پوشیده شده اند. این فرایند، انحلال یونی به شمار می رود.
- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
انحلال پذیری گازها در آب
فصل 3 : آب، آهنگ زندگی
انحلال پذیری گازها در آب
نوع گاز
گازهایی که مولکول های ناقطبی دارند اغلب انحلال پذیری کمی در آب دارند مانند گازهای 2Oو N2، هر چه مولکول ناقطبی بزرگ تر و سنگین تر باشند جاذبه ی قوی تری با آب ایجاد می کند و انحلال پذیری آن در آب بیش تر است به عنوان مثال انحلال پذیری گاز نیتروزن از گاز هیدروژن بیش تر است.
دما
انحلال پذیری گازها با دما رابطه ی عکس دارد یعنی با کاهش دما انحلال پذیری گازها افزایش می یابد به همین علت ماهی ها در هوای گرم به سطح آب می آیند چون در هوای گرم انحلال پذیری گاز اکسیژن در آب کاهش می یابد.
فشار
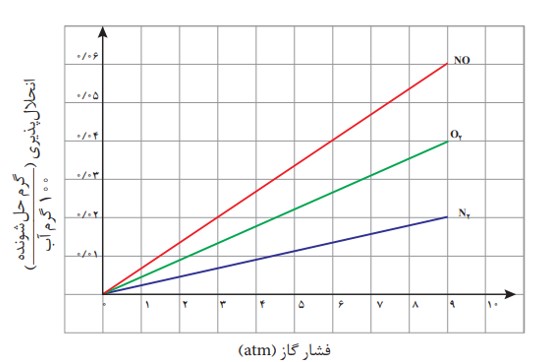
برای این که یک گاز بتواند در آب یا حلال دیگر حل شود باید ذره های آن لا به لای مولکول های آب قرار گیرند که با افزایش فشار تعداد بیش تری ذره های گاز در سطح آب قرار می گیرند برهم کنش آن ها با مولکول های آب بیش تر می شود در نتیجه انحلال پذیری آن ها افزایش می یابد. اثر افزایش فشار بر انحلال پذیری گازها نخستین بار توسط ویلیام هنری در سال 1803 میلادی بررسی شد به همین علت به قانون هنری معروف است که طبق این قانون انحلال پذیری گازها با فشار رابطه مستقیم دارد در دمای ثابت با افزایش فشار انحلال پذیری گازها افزایش می یابد نمودار انحلال پذیری گازها برحسب فشار به صورت خطی با شیب ثابت و مثبت است و انحلال پذیری گازها در دمای صفر درجه برابر صفر است یعنی عرض از مبدا نمودار انحلال پذیری گازها برحسب فشار برابر صفر است و معادله ی انحلال پذیری برحسب فشار به صورت \(S = K \times P\) می باشد به عنوان مثال اگر فشار یک گاز را دو برابر کنیم انحلال پذیری آن دو برابر می شود ولی نمودار انحلال پذیری گازها برحسب دما به صورت منحنی بوده و شیب آن در دماهای مختلف متفاوت است.
اثر مقدار ماده حل شونده
با افزایش مقدار یک ماده حل شونده انحلال پذیری گازها در آن محلول کم می شود زیرا یون ها یا مولکول های ماده حل شونده در آب با مولکول های آب نیروی جاذبه ی قوی یون - دوقطبی تشکیل می دهند بنابراین تمایل مولکول های آب به جذب مولکول های گاز کم می شود به هم علت وقتی که شما یک حبه قند و یا مقداری نمک داخل نوشابه می ریزید مقداری از گاز نوشابه خارج می شود.
یون پتاسیم در بدن
یکی از مهم ترین یون ها در مایع های بدن، یون پتاسیم K+ نیاز روزانه بدن هر فرد بالغ به یون پتاسیم دو برابر یون سدیم است. از آنجا که بیشتر مواد غذایی حاوی یون پتاسیم K+ برای تنظیم و عملکرد مناسب است، کمبود آن به ندرت احساس می شود. وجود یون پتاسیم دستگاه عصبی بسیار ضروری است به طوری که انتقال پیام های عصبی بدون وجود این یون، امکان پذیر نیست. درواقع، اختلال در حرکت این یون مانع از انتقال پیام های عصبی و گاهی در موارد شدید منجر به مرگ می شود.
ردپای آب در زندگی
فصل 3 : آب، آهنگ زندگی
ردپای آب در زندگی
هر فرد، روزانه در حدود 350 لیتر آب مصرف می كند. این مقدار آب افزون بر نوشیدن، شامل پخت و پز ، شستشو در آشپزخانه، نظافت، شستشوی لباس و .... است. مصرف آب به فعالیت های روزانه هر شخص محدود نمی شود، بلكه روزانه در صنایع گوناگون، حجم بسیار زیادی آب استفاده می شود. در میان صنایع، صنعت كشاورزی بیشترین حجم آب مصرفی را به خود اختصاص داده است. بررسی ها نشان می دهند كه برای تولید هر وسیله، كالا یا فراورده مقدار معینی آب نیاز است.
همانند ردپای کربن دی اکسید، برای هر فرد، ردپای آب نیز تعریف می شود. درواقع، ردپای آب نشان می دهد كه هر فرد چه مقدار از آب قابل استفاده و در دسترس مصرف می کند و در نتیجه چه مقدار از حجم منابع آب کم می شود. این میزان، همۀ آبی را كه در تولید كالاها، ارائه خدمات و فعالیت های گوناگون مصرف می شود، نشان می دهد. برای مثال اگر شما سالانه 150كیلوگرم گندم مصرف كنید، ردپای آب شما در تولید این مقدار گندم برابر با 274500 لیتر خواهد بود. با حساب كردن همۀ آب مصرفی در زندگی سالانه هر فرد می توان میانگنی ردپای آب او را برآورد كرد. هر چه رد پای آب ایجاد شده، سنگین تر باشد، منابع آب شیرین بیشتر مصرف می شوند و زودتر به پایان می رسند. برآوردهای پژوهشگران نشان می دهد که میانگین ردپای آب برای هر فرد در یک سال در حدود 1000000 لیتر است.
این ردپا شامل همه آب های مصرفی در کشاورزی، دامداری، نساجی، بهداشت، خانه، مدرسه، دانشگاه و... است که همگی از آب های سطحی یا زیرزمینی تأمین می شود. توجه کنید که آب آشامیدنی با آب مصرفی در دیگر صنایع متفاوت است؛ به طوریكه ممكن است آبی برای شستشو مناسب باشد اما آشامیدنی نباشد. هر چند كه آب دریاها و اقیانوس ها، منبع بسیار بزرگی برای تهیۀ آب به شمار می آیند، اما به اندازه ای شور هستند كه باید قبل از مصرف، نمك زدایی و تصفیه شوند.
اسمز در زندگی
هنگامی كه حبوبات و میوه های خشك را برای مدتی درون آب قرار می دهیم، متورم می شوند در حالی كه خیار در آب شور چروكیده می گردد.
دیوارۀ یاخته ها در گیاهان روزنه هایی بسیار ریز دارد كه ذره های سازندۀ مواد می توانند از آن گذر كنند. به گونه ای كه این روزنه ها فقط اجازۀ گذر به برخی از ذره ها و مولكول های كوچك مانند آب و یون ها را می دهند و از گذر مولكول های درشت تر جلوگیری می كنند. این دیواره ها غشای نیمه تراوا نامیده می شوند.
1 هنگـامی كه میـوه هـای خشك مانند مویز درون آب قرار می گیرند، مولكول هـای آب، خـود بـه خـود از محیط رقیق با گذر از روزنه های دیوارۀ سلولی به محیط غلیظ می روند. در نتیجه، میوه آبدار و متورم می شود.
2 گذرندگی (اسمز) نامی است که به این فرایند داده اند. در این فرایند، برخی نمك ها ، ویتامین ها و ... از بافت میوه به آب راه می یابد.
اسمز و اسمز معکوس
فصل 3 : آب، آهنگ زندگی
اسمز و اسمز معکوس
اگر حجم های یکسانی از آب خالص و محلول آب نمک توسط یک غشای نیم تراوا (غشایی مانند سلوفان که برخی از مولکول ها، نه همه آن ها، را از خود عبور می دهد، غشای نیمه تراوا نامیده می شود) جدا شده باشند غشایی که فقط مولکول های آب بتواند از درون آن بگذرد و یون های سدیم و کلر نتواند عبور کنند در این حالت مولکول های آب در هر دو جهت حرکت می کنند ولی سرعت حرکت این مولکول ها از سمت آب خالص به سمت محلول آب نمک بیش تر است چون تعداد مولکول های آب در آب خالص نسبت به محلول آب نمک بیش تر است. به حرکت مولکول های آب از درون یک غشای نیمه تراوا از سمت محلول رقیق تر به سمت محلول غلیظ تر و یا از سمت حلال خالص به سمت محلول، اسمز می گویند که با گذشت زمان حجم محلول غلیظ تر افزایش و حجم محلول رقیق تر کاهش می یابد.
اگر حجم های یکسانی از آب خالص و محلول آب نمک توسط یک غشای نیم تراوا جدا شده باشند و روی سطح محلول آب نمک فشاری بیش تر از فشار اسمزی وارد کنیم در این حالت مولکول های آب در هر دو جهت حرکت می کنند ولی سرعت حرکت این مولکول ها از سمت محول آب نمک به سمت آب خالص بیش تر است چون فشار وارد بیش تر از فشار اسمزی است یعنی آب از محلول غلیظ تر جدا شده و پس از عبور از غشا نیم تراوا به طرف محلول رقیق تر می رود به همین علت به این فرآیند اسمز معکوس می گویند. که با گذشت زمان حجم محلول غلیظ تر کاهش و حجم آب خالص افزایش می یابد. فرآیند اسمز معکوس برای تولید آب شیرین از آب دریا به کار می رود.
- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم



1736019749.png)















