جواب با هم بیندیشیم صفحه 108 درس 4 شیمی دوازدهم (شیمی، راهی به سوی آینده ای روشن تر)
تعداد بازدید : 80.99Mپاسخ با هم بیندیشیم صفحه 108 شیمی دوازدهم
-گام به گام با هم بیندیشیم صفحه 108 درس شیمی، راهی به سوی آینده ای روشن تر
-با هم بیندیشیم صفحه 108 درس 4
-شما در حال مشاهده جواب با هم بیندیشیم صفحه 108 شیمی دوازدهم هستید. ما در تیم مای درس، پاسخنامههای کاملاً تشریحی و استاندارد را مطابق با آخرین تغییرات کتاب درسی 1404 برای شما گردآوری کردهایم. اگر به دنبال بهروزترین پاسخها برای این صفحه هستید و میخواهید بدون نیاز به اتصال به اینترنت، علاوه بر پاسخهای گام به گام، به گنجینهای از مطالب درسی دسترسی پیدا کنید، حتماً اپلیکیشن مایدرس را نصب نمایید.
📥 دانلود اپلیکیشن مایدرس
برای دسترسی آفلاین، سریع و بدون نیاز به اینترنت به گنجینهای از گامبهگامها و نمونه سوالات، اپلیکیشن را نصب کنید.
1- جدول داده شده اثر دما را بر ثابت تعادل زیر نشان می دهد . با توجه به آن به پرسش ها پاسخ دهید.
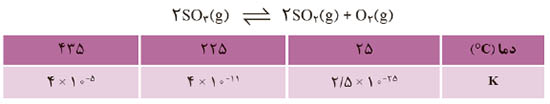
آ) عبارت ثابت تعادل را برای آن بنویسید.
ب) میزان پیشرفت واکنش در کدام دما بیشتر است؟ چرا؟
پ) با افزایش دما K چه تغییری کرده است؟ این تغییر، جابه جا شدن تعادل را در چه جهتی نشان میدهد؟
ت) اگر برای این واکنش ΔH>0 باشد، جا به جا شدن تعادل و افزایش K را به کمک اصل لوشاتلیه توجیه کنید.
2- با خط زدن واژه نادرست در هر مورد، عبارت زیر را کامل کنید.
هنگامی که دمای یک سامانه تعادلی افزایش مییابد، واکنش در جهت (مصرف / تولید) گرما پیش میرود، اگر این واکنش گرماگیر باشد مقدار (فراوردهها / واکنش دهندهها) در سامانه کاهش مییابد.
3ــ نمودار زیر درصد مولی آمونیاک را برای سامانه تعادلی زیر در فشار ثابت نشان می دهد. باتوجه به آن به پرسش ها پاسخ دهید.
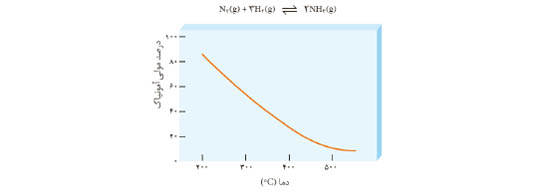
آ) با افزایش دما درصد مولی آمونیاک در سامانه چه تغییری می کند؟
ب) این واکنش گرماده است یا گرماگیر؟ چرا؟
پ) مقدار ثابت تعادل آن در سه دمای 25 ،200 و 400 درجه سلسیوس به صورت زیر است.
K1 = 6/2 × 10-4 , K2 = 2/24 , K3 = 6/0 × 105
کدام یک، ثابت تعادل را در دمای اتاق نشان می دهد؟ توضیح دهید.
1- آ)

ب) دمای 435∘C، زیرا K تعادل بزرگتر شده است، یعنی درصد بیشتری از مواد واکنشدهنده به فراورده تبدیل شده است.
پ) با افزایش دما K بزرگتر شده است، یعنی تعادل در جهت واکنش رفت جابهجا شده است.
ت) با افزایش دما و بزرگتر شدن K متوجه میشویم که تعادل گرماگیر است.
طبق اصل لوشاتلیه ¬ با افزایش دما (T) واکنش به سمت مصرف گرما پیش میرود و تعادل به سمت واکنش گرماگیر جابهجا میشود، یعنی تعادل به سمت واکنش رفت پیش میرود.
2- هنگامی که دمای یک سامانه تعادلی افزایش مییابد، واکنش در جهت (مصرف) گرما پیش میرود، اگر این واکنش گرماگیر باشد مقدار (واکنش دهندهها) در سامانه کاهش مییابد.
3- آ) کاهش مییابد.
ب) واکنش گرماده است، زیرا با افزایش دما طبق اصل لوشاتلیه واکنش باید در جهت مصرف گرما (گرماگیر) پیش رود. با توجه به کاهش درصد مولی آمونیاک بر اثر افزایش دما متوجه میشویم که واکنش در جهت برگشت جابهجا شده است.

پ) K1، مطابق نمودار در دمای اتاق درصد مولی آمونیاک بسیار ناچیز است، پس واکنش پیشرفت کمی داشته و K تعادل باید بسیار کوچک باشد.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه چهارم تا دوازدهم- آزمون آنلاین تمامی دروس
- گام به گام تمامی دروس
- ویدئو های آموزشی تمامی دروس
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس
- فلش کارت های آماده دروس
- گنجینه ای جامع از انشاء های آماده
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه



1736019749.png)















