درسنامه کامل شیمی یازدهم
تعداد بازدید : 497.11kخلاصه نکات شیمی یازدهم - درسنامه شب امتحان شیمی یازدهم - جزوه شب امتحان شیمی یازدهم نوبت اول
هدایای زمینی
فصل 1 : قدر هدایای زمینی را بدانیم
هدایای زمینی
مواد در زندگی ما نقشی شگرف و مؤثر دارند به طوری كه صنایع گوناگون مانند غذا، پوشاک، حمل و نقل، ساختمان، ارتباطات و هر بخش از زندگی ما كم و بیش تحت تأثیر مواد قرار دارند. اغراق نیست اگر رشد و گسترش تمدن بشری را در گرو كشف و شناخت مواد جدید بدانیم. بررسی تمدن ها از گذشته تاكنون نشان می دهد كه توسعه جوامع انسانی به توانمندی افرادی هوشمند گره خورده است. انسان های پیشین فقط از برخی مواد طبیعی مانند چوب، سنگ، خاک، پشم و پوست بهره می بردند، اما با گذشت زمان توانستند موادی مانند سفال را تولید و برخی فلزها را نیز استخراج كنند كه خواص مناسب تری داشتند. با گسترش دانش تجربی، شیمی دان ها به رابطه میان خواص مواد با عنصرهای سازندۀ آنها پی بردند. آنها همچنین دریافتند كه گرما دادن به مواد و افزودن آنها به یكدیگر سبب تغییر و گاهی بهبود خواص می شود. با این روند، آنها به توانایی انتخاب مناسب ترین ماده برای یک كاربرد معین دست یافتند تا جایی كه می توانند موادی نو با ویژگی های منحصر به فرد و دلخواه طراحی كنند. امروزه با رشد و توسعه فناوری، هزاران ماده تهیه و تولید شده كه زندگی مدرن و پیچیده امروزی را ممكن كرده است.
گسترش فناوری به میزان دسترسی به مواد مناسب وابسته است، به طوری كه كشف و درک خواص یک مادۀ جدید پرچمدار توسعۀ فناوری است. برای نمونه گسترش صنعت خودرو مدیون شناخت و دسترسی به فولاد است. همچنین پیشرفت صنعت الكترونیک بر اجزایی مبتنی است كه از موادی به نام نیمه رساناها ساخته می شوند.
نمودار زیر برآورد میزان تولید یا مصرف نسبی برخی مواد را در جهان نشان می دهد.
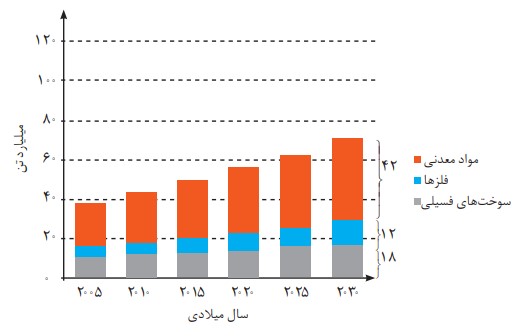
با توجه به نمودار:
الف) در سال 2015 به تقریب چند میلیارد تن فلز در جهان استخراج و مصرف شده است؟
حدود 7 میلیارد تن
ب) پیشبینی می شود كه در سال 2030 به تقریب در مجموع چند میلیارد تن از این مواد استخراج و مصرف شوند؟ بیش از 71 میلیارد تن برای هر سه منبع و برای فلزها حدود 12 میلیارد تن مصرف مواد معدنی بیش از سوخت های فسیلی و سوخت فسیلی بیش تر از فلزات است.
منشاء همه چیز زمین است
زندگی روزانۀ ما به منابع شیمیایی وابسته است. صبحانۀ امروز خود را در نظر بگیرید، چای خود را با استکانی شیشه ای نوشیده اید که از شن و ماسه ساخته شده است، در ظرفی که از خاک چینی ساخته شده است، غذا خورده اید و برای هم زدن چای از قاشقی استفاده كرده اید كه از فولاد زنگ نزن ساخته شده است. فولادی كه پس از طی مراحل طولانی از سنگ معدن به دست می آید. همچنین برای طعم دادن به غذای خود، نمک به دست آمده از خشكی و دریا را روی آن پاشیده اید؛ سبزیجات و میوه هایی را خورده اید كه با استفاده از کودهای پتاسیم، نیتروژن و فسفردار رشد كرده اند. از سوی دیگر، سوختی را که با استفاده از آن خانه را گرم یا باک خودرو را پر می كنید، از دل زمین بیرون كشیده اند. با پیشرفت صنعت، شهرها و روستاها گسترش یافتند و سطح رفاه در جامعه بالاتر رفت؛ با این روند میزان مصرف منابع گوناگون نیز افزایش یافت.
تأمین این نیازها به همراه تولید انواع دستگاه ها و ابزارآلات صنعتی، نظامی، كشاورزی و دارویی، سبب شده است تا تقاضای جهانی برای استفاده از هدایای زمینی افزایش یابد، به گونه ای كه سالانه حجم انبوهی از منابع شیمیایی بهره برداری می شود. زمین انباری از ذخایر ارزشمند است كه بی هیچ منتی به ما هدیه شده است، هرچند که این منابع به طور یكسان توزیع نشده اند.
با کمی اندیشیدن این پرسش ها مطرح می شود که این هدایای زمینی به چه شكلی استفاده می شوند؟ آیا آنها به همان شكل مصرف می شوند یا آنها را به عنصرهای سازنده تبدیل می کنند، سپس به كار می برند؟ چگونه می توان تشخیص داد كه در یک نمونه سنگ معدن، كدام عنصرها وجود دارد و به چه میزانی قابل استخراج است؟ روش های استخراج و تهیۀ یک عنصر چیست؟ استخراج یک مادۀ شیمیایی چه آثاری روی محیط زیست برجای می گذارد؟ آیا مصرف مواد به صورت خام مقرون به صرفه است یا فراوری شده؟ بهره برداری از هدایای زمینی بر چرخه های طبیعی چه اثری دارد؟ شیوه های حفظ و نگهداری این منابع ارزشمند برای آیندگان چیست؟ علم شیمی و شیمی دان ها چه نقشی در استفاده از این منابع مبتنی بر توسعۀ پایدار دارند؟
شیمی دان ها برای یافتن پاسخ این پرسش ها، در پی كشف الگوها و روندهای موجود در رفتار مواد و عنصرها هستند.
دانشمندان برجسته و بزرگ، دانشمندانی هستند كه می توانند با بررسی دقیق اطلاعات و یافته های موجود دربارۀ مواد و پدیده های گوناگون، الگوها، روندها و روابط بین آنها را درک کنند و توضیح دهند. مندلیف یكی از آنها است كه جدول دورهای را طراحی كرده است.
- آزمون آنلاین تمامی دروس پایه یازدهم
- گام به گام تمامی دروس پایه یازدهم
- ویدئو های آموزشی تمامی دروس پایه یازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه یازدهم
- فلش کارت های آماده دروس پایه یازدهم
- گنجینه ای جامع از انشاء های آماده پایه یازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه یازدهم
الگوها و روند ها در رفتار مواد و عناصر
فصل 1 : قدر هدایای زمینی را بدانیم
الگوها و روند ها در رفتار مواد و عناصر
شیمی دان ها با مشاهدۀ مواد و انجام آزمایش های گوناگون، آنها را دقیق بررسی می کنند. هدف همۀ این بررسی ها، یافتن اطلاعات بیشتر و دقیق تر دربارۀ ویژگی ها و خواص مواد است. اما برقراری ارتباط میان این داده ها و اطلاعات، همچنین یافتن الگوها و روندها گامی مهمتر و مؤثرتر در پیشرفت علم به شمار می آید زیرا بر اساس این روندها، الگوها و روابط می توان به رمز و راز هستی پی برد. علم شیمی را می توان مطالعۀ هدف دار، منظم و هوشمندانۀ رفتار عنصرها و مواد برای یافتن روندها و الگوهای رفتار فیزیكی و شیمیایی آنها دانست. جدول دوره ای عنصرها، نمایشی بی نظیر از چیدمان عنصرها بوده و همانند یك نقشه راه برای شیمی دانهاست كه به آنها كمک می كند حجم انبوهی از مشاهده ها را سازماندهی و تجزیه و تحلیل كنند تا الگوهای پنهان در رفتار عنصرها را آشکار نمایند.
در شیمی سال دهم آموختید كه عنصرها در جدول دورهای بر اساس بنیادی ترین ویژگی آنها یعنی عدد اتمی (Z)، چیده شده اند. در این جدول، عنصرهایی كه آرایش الکترونی لایۀ ظرفیت اتم آنها مشابه است، در یک گروه جای گرفته اند. این جدول شامل 7 دوره و 18 گروه است. همچنین دریافتید تعیین موقعیت (دوره و گروه) یک عنصر در جدول دوره ای، كمك شایانی به پیشبینی خواص و رفتار آن خواهد كرد. بررسی ها نشان می دهند كه عنصرهای جدول دوره ای را بر اساس رفتار آنها می توان در سه دسته شامل فلز، نافلز و شبه فلز جای داد. با برخی رفتار فلزها آشنا هستید. با بررسی این رفتارها میتوان ضمن دسته بندی عنصرها، به روندها و الگوهای موجود در خواص آنها پی برد.
هلیم با اینکه در گروه 18 جدول دورهای عنصرها جای دارد، اما عنصری از دسته s است و آرایش الکترونی لایه ظرفیت آن با دیگر گازهای جنیب متفاوت است.
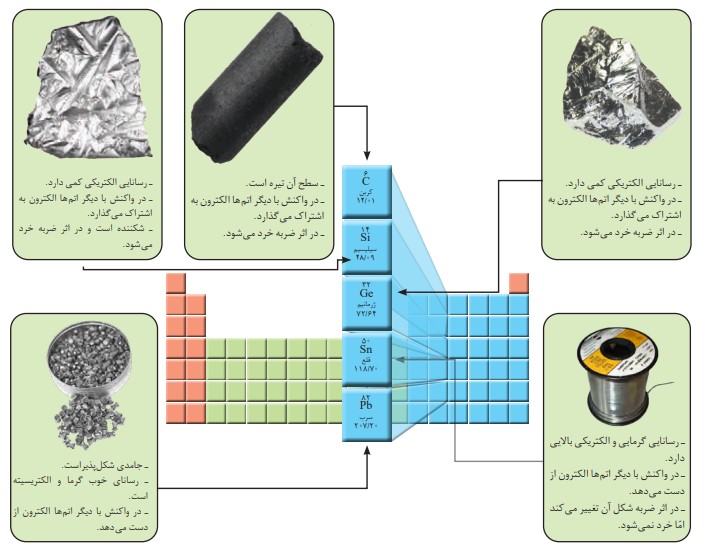
الف) عنصر های گروه 14
در شكل (الف) سطح كدام عنصرها براق و صیقلی است؟
سیلیسیم، ژرمانیم ، قلع و سرب
در شكل (الف) كدام عنصرها ویژگی های مشترک بیشتری با یکدیگر دارند (رفتارهای فیزیكی و شیمیایی آنها شبیه هم هستند)؟
قلع و سرب باهم و سیلیسیم و ژرمانیم باهم
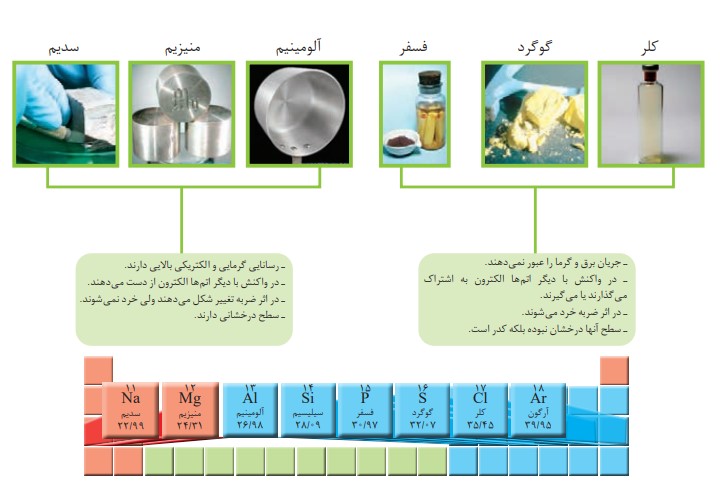
ب) عنصر های دوره سوم
شكل های (الف) و (ب) را با هم مقایسه و مشخص كنید رفتار كدام عنصرها به یكدیگر شباهت بیشتری دارند. نتیجۀ مقایسۀ خود را یادداشت كنید.
با توجه به رسانایی الکتریکی و گرمایی و رفتار شیمیایی
سدیم ، منیزیم، آلومینیم ، قلع و سرب
کربن ، فسفر ، گوگرد و کلر
سیلیسیم و ژرمانیم
سه دسته عنصر فلزی و نافلزی و عنصرهای که در برخی خواص به هر دو دسته شبیه هستند دیده می شود.
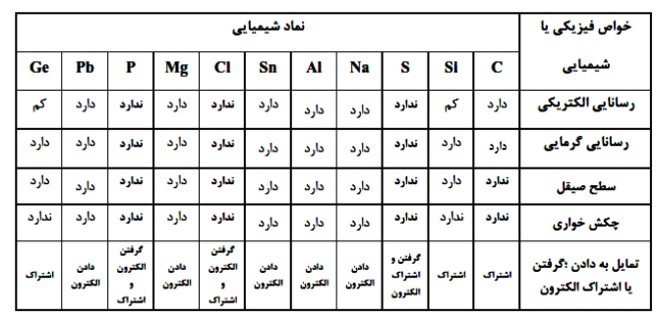
1 فلز : سدیم ، منیزیم، آلومینیم ، قلع و سرب
2 نافلز: کربن ، فسفر ، گوگرد و کلر
3 شبه فلز: سیلیسیم و ژرمانیم
4 در هر دوره از جدول دوره ای، از چپ به راست از خاصیت فلزی کاسته و به خاصیت نافلزی افزوده می شود، همچنین در هر گروه از جدول دوره ای از بالا به پایین خاصیت فلزی افزایش یافته و از پایین به بالا خاصیت نافلزی افزایش می یابد.
بیشتر عنصرهای جدول دوره ای را فلزها تشكیل می دهند كه به طور عمده در سمت چپ و مركز جدول قراردارند. اما نافلزها در سمت راست و بالای جدول چیده شده اند. شبه فلزها همانند مرزی بین فلزها و نافلزها قرار دارند. خواص فیزیكی شبه فلزها بیشتر به فلزها شبیه بوده در حالی كه رفتار شیمیایی آنها همانند نافلزها است. دیدید كه خصلت فلزی در یک دوره از چپ به راست كاهش می یابد و در یك گروه از بالا به پایین افزایش می یابد. این روند در دیگر گروه ها و دوره ها نیز مشاهده می شود. به دیگر سخن خواص فیزیكی و شیمیایی عنصرها به صورت دوره ای تكرار می شود كه به قانون دورهای عنصرها معروف است.
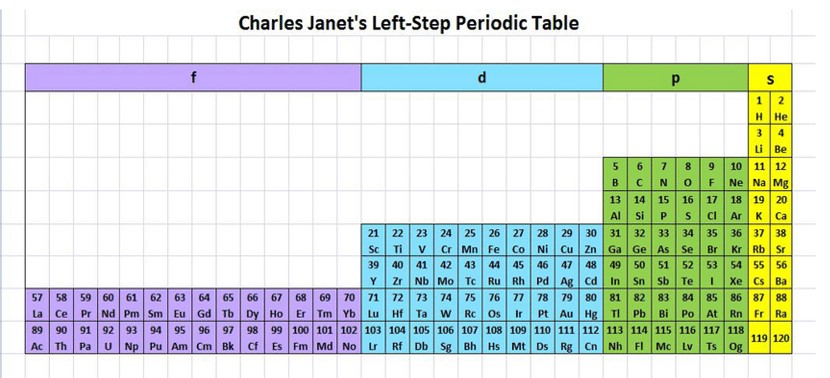
جدول ارائه شده توسط شارل ژانت (Charles janet)
می دانید كه همۀ 118 عنصر جدول دورهای شناسایی و توسط آیوپاک تأیید شده است، به طوری كه هیچ خانه ای در جدول خالی نیست. بنابراین چنین به نظر می رسد كه جست و جو برای كشف عنصرهای طبیعی به پایان رسیده و تنها راه افزایش شمار عنصرها، تهیه و تولید آنها به صورت ساختگی است. شاید شما نیز گزارش هایی دربارۀ ساخت و شناسایی عنصر شمارۀ 120 یا 121 در آزمایشگاه های تحقیقاتی و مدرن شنیده باشید. شناسایی عنصرها با عدد اتمی بیشتر از 118، سبب خواهد شد تا طبقه بندی تازه ای از عنصرها ارائه شود زیرا در جدول دوره ای امروزی، جایی برای آنها پیشبینی نشده است.
شارل ژانت شیمی دان فرانسوی در سال 1927 با کنار هم چیدن عنصرهای شناخته شده در زمان خود، الگویی ارائه کرد كه بر اساس آن می توان عنصرهای با عدد اتمی بزرگتر از 118 را نیز طبقه بندی كرد.
جدول پیشنهادی شارل ژانت با مدل کوانتومی همخوانی داشت. در دو ردیف جدید این جدول، زیر لایه g به عنوان زیر لایه پنجم پس از زیر لایه های s,p.dوf پر می شود.
رفتار عنصرها و شعاع اتم
فصل 1 : قدر هدایای زمینی را بدانیم
رفتار عنصرها و شعاع اتم
رفتارهای فیزیكی فلزها شامل داشتن جلا، رسانایی الكتریكی و گرمایی، خاصیت چكش خواری، شكل پذیری (مانند قابلیت ورقه و مفتول شدن) و... است. در حالی كه رفتار شیمیایی فلزها به میزان توانایی اتم آنها به از دست دادن الكترون وابسته است. هر چه اتم فلزی در شرایط معین آسان تر الكترون از دست بدهد، خصلت فلزی بیشتری دارد و فعالیت شیمیایی آن بیشتر است. روندهای تناوبی در جدول بر اساس كمیت های وابسته به اتم قابل توضیح است. یكی از این كمیت ها، شعاع اتمی است. در شیمی دهم آموختید كه مطابق مدل کوانتومی، اتم را مانند كره ای در نظر می گیرند كه الكترون ها پیرامون هسته و در لایه های الكترونی در حال حركت اند. بنابراین می توان برای هر اتم شعاعی در نظر گرفت و آن را اندازه گیری كرد. بدیهی است که شعاع اتم های مختلف، یكسان نیست و هرچه شعاع یک اتم بزرگتر باشد، اندازۀ آن اتم نیز بزرگتر است.
آیا میان شعاع اتم ها و خصلت فلزی یا نافلزی آنها رابطه ای هست؟ اكنون با انجام دادن فعالیت صفحه بعد به رابطه بین خصلت فلزی و نافلزی با شعاع اتم پی می برید.

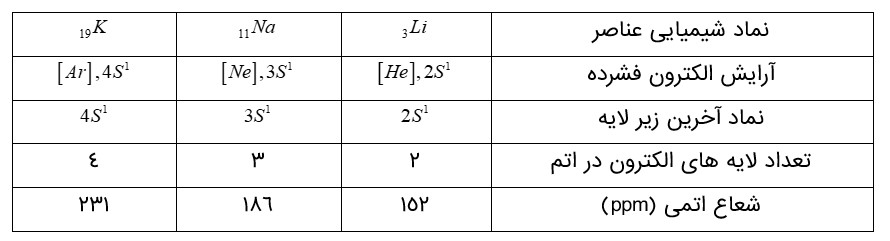
الف) با توجه به جایگاه عنصرهای لیتیم، سدیم و پتاسیم (فلزهای قلیایی) در جدول دوره ای، پیشبینی كنید در واكنش با گاز كلر، اتم های كدام یک آسان تر الكترون از دست خواهد داد؟ چرا؟
پتاسیم، زیرا در گروه پایین تر است و خصلت فلزی یعنی تمایل به از دست دادن الکترون بیشتری دارد و در نتیجه آسان تر الکترون می دهد.
ب) تصویر بالا واكنش این فلزها با گاز كلر را در شرایط یکسان نشان می دهد. آیا داده های این تصویر پیشبینی شما را تأیید می كند؟
بله . در تصویر، (شدت واکنش) بر اساس شدت نور برای پتاسیم بیشتر است .
هرچه ماده ای سریع تر و شدید تر واكنش بدهد، فعالیت شیمیایی بیشتری دارد.
ج) به نظر شما آیا جملۀ (هرچه شعاع اتمی یک فلز بزرگ تر باشد، آسان تر الكترون از دست می دهد) درست است؟ چرا؟
بله شعاع اتمی پتاسیم بزرگ تر از سدیم و لیتیم است و طبق تصویر بالا واکنش پذیری آن نیز بیشتر است. بنابراین با بزرگتر شدن اندازه اتم ، خاصیت فلزی بیشتر و تمایل به از دست دادن الکترون بیشتر می شود. با بزرگتر شدن اتم جاذبه هسته بر روی الکترون کم تر می شود.
تولید نور، آزادسازی گرما، تشكیل رسوب و خروج گاز نشانه هایی از تغییر شیمیایی هستند. هرچه شدت نور یا آهنگ خروج گاز آزاد شده بیشتر باشد، واكنش شیمیایی سریع تر و شدید تر بوده و واكنش دهنده فعالیت شیمیایی بیشتری دارد.
با توجه به جدول زیر، پیشبینی كنید اتم كدام یک از فلزهای گروه دوم (فلزهای قلیایی خاکی) جدول دوره ای در واكنش با نافلزها، آسان تر به كاتیون \({M^{2 + }}\) تبدیل می شود. چرا؟
(استرانسیم) چون شعاع اتمی بزرگتری دارد پس تمایل به از دست دادن الکترون بیشتر است.
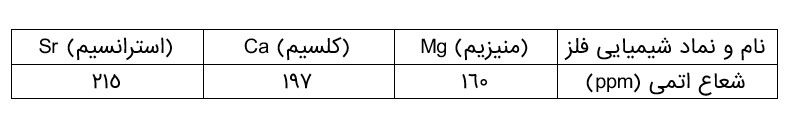
یكی دیگر از روندهای تناوبی، روند تغییر شعاع اتمی عنصرهای جدول دوره ای است. در یک گروه، از بالا به پایین شعاع اتمی افزایش می یابد، زیرا تعداد لایه های الكترونی بیشتر می شود. در حالی كه در یک دوره، شعاع اتمی عنصرها از چپ به راست كاهش می یابد؛ زیرا در یک دوره، تعداد لایه های الكترونی ثابت می ماند در حالی كه تعداد پروتون های هسته افزایش می یابد. با افزایش تعداد پروتون ها، نیروی جاذبه ای كه هسته به الكترون ها وارد می كند افزایش یافته و بدین ترتیب شعاع اتم كاهش می یابد.
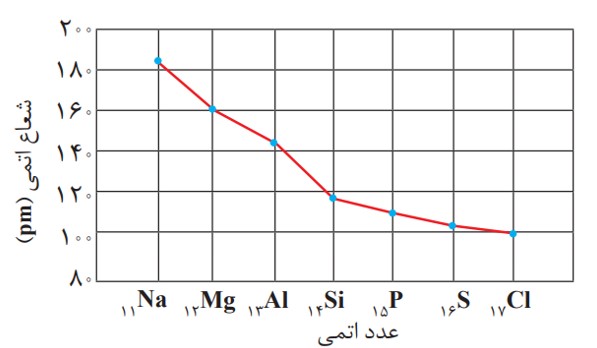
نمودار تغییر شعاع اتمی در دوره سوم جدول دوره ای
نافلزها در واكنش های شیمیایی برخلاف فلزها متایل دارند با گرفتن الكترون به آنیون تبدیل شوند. برای مثال نافلزهای گروه 17 (هالوژن ها) با گرفتن یک الكترون به آنیون با یک بار منفی (یون هالید) تبدیل می شوند.

الف) پیش بینی کنید در شرایط یکسان کدام هالوژن واکنش پذیر تر است؟چرا؟
فلوئور F زیرا اندازه اتم کوچکتری دارد و تمایل آن برای گرفتن الکترون بیشتر است.
ب) توضیح دهید خصلت نافلزی با شعاع اتمی چه رابطه ای دارد؟
رابطه وارونه؛ هرچه شعاع اتمی نافلز کمتر باشد خصلت نافلزی آن یعنی تمایل به گرفتن الکترون، بیشتر است.
اگرچه همۀ فلزها در حالت های کلی رفتارهای مشابهی دارند، اما تفاوت های قابل توجهی میان آنها وجود دارد، به طوری كه هر فلز رفتارهای ویژۀ خود را دارد. برای نمونه، فلز سدیم نرم است و با چاقو بریده شده و به سرعت در هوا تیره می شود اما آهن فلزی محكم است و از آن برای ساخت در و پنجرۀ فلزی استفاده می شود. این فلز با اكسیژن در هوای مرطوب به كندی واكنش می دهد و به زنگ آهن تبدیل می شود. این در حالی است كه طلا در گذر زمان جالی فلزی خود را حفظ می كند و همچنان خوش رنگ و درخشان باقی می ماند. فلزهای دستۀ d نیز رفتاری شبیه فلزهای دستۀ s و p دارند. آنها نیز رسانای جریان الكتریكی و گرما هستند، چكش خوارند و قابلیت ورقه شدن دارند.
عناصر دسته d
فصل 1 : قدر هدایای زمینی را بدانیم
عناصر دسته d
فلزهای دستۀ d، دسته ای از عنصرهای جدول دورهای هستند كه زیر لایۀ d اتم آنها در حال پر شدن است. در شكل زیر نخستین سری از این فلزها كه در دورۀ چهارم جدول جای دارند، نشان داده شده است.
فلزهای دستۀ d، به فلزهای واسطه معروف اند در حالی كه فلزهای دسته sو p به فلزهای اصلی شهرت دارند.
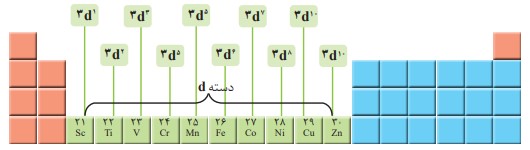
اغلب این فلزها در طبیعت به شکل ترکیب های یونی همچون اکسیدها، کربنات ها و... یافت می شوند. برای نمونه آهن، دو اکسید طبیعی با فرمول های \(FeO\) و \(F{e_2}{O_3}\) دارد.
فلزهای دستۀ d به هنگام تشکیل كاتیون، الکترون های بیرونی ترین زیر لایه خود را از دست می دهند. پس آرایش یون های \(F{e^{2 + }}\) و \(F{e^{3 + }}\) به صورت زیر خواهد بود:
\(Fe:\left[ {Ar} \right],3{d^6},4{s^2} \to - 2e \to F{e^{2 + }}:\left[ {Ar} \right],3{d^6}\)
\(F{e^{2 + }}:\left[ {Ar} \right],3{d^6} \to - e \to F{e^{3 + }}:\left[ {Ar} \right],3{d^5}\)
همان گونه كه می بینید آرایش الكترونی یون های \(F{e^{2 + }}\) و \(F{e^{3 + }}\) همانند آرایش الكترونی هیچ گاز نجیبی نیست. بررسی ها نشان می دهد که اتم اغلب فلزهای واسطه با تشکیل کاتیون به آرایش گاز نجیب دست نمی یابند؛ در حالی كه كاتیون حاصل از فلزهای اصلی اغلب به آرایش پایدار گاز نجیب می رسند، مانند:
\({}_3Li:\left[ {{}_2He} \right],2{s^1} \to {}_3L{i^ + }:\left[ {{}_2He} \right]\)
\({}_{30}Zn:\left[ {{}_{18}Ar} \right],3{d^{10}},4{s^2} \to {}_{30}Z{n^{2 + }}:\left[ {{}_{18}Ar} \right],3{d^{10}}\)
آرایش الكترونی یون روی (Zn) شبیه هیچ گاز جنیبی نیست.
طلا فلزی ارزشمند و گرانبها است كه افزون بر ویژگی های مشترک فلزها، ویژگی های منحصر به فردی نیز دارد. فلز طلا به اندازه ای چكش خوار و نرم است كه چند گرم از آن را می توان با چكش كاری به صفحه ای با مساحت چند متر مربع تبدیل كرد. به همین دلیل ساخت برگه ها و رشته سیم های بسیار نازك (نخ طلا) به راحتی امكان پذیر است. رسانایی الكتریكی بالای طلا و حفظ این رسانایی در شرایط دمایی گوناگون، همچنین واكنش ندادن آن با گازهای موجود در هواكره و مواد موجود در بدن انسان همراه با بازتاب زیاد پرتوهای خورشیدی از جمله ویژگی های خاص طلاست كه سبب شده كاربردهای این فلز گسترش یافته و تقاضای جهانی آن روز به روز افزایش یابد هر چند طلا در طبیعت به شكل فلزی و عنصری خود نیز یافت می شود، اما مقدار آن در معادن طلا بسیار كم است. به طوری كه برای استخراج مقدار كمی از آن باید از حجم انبوهی خاک معدن استفاده کرد. به همین دلیل پسماند بسیار زیادی تولید می شود.
1 استخراج طلا همانند دیگر فعالیت های صنعتی آثار زیان بار زیست محیطی بر جای می گذارد.
2 مجتمع طلای موته در اصفهان و زرشوران در آذربایجان غربی از منابع استخراج طلا در ایران هستند.
- آزمون آنلاین تمامی دروس پایه یازدهم
- گام به گام تمامی دروس پایه یازدهم
- ویدئو های آموزشی تمامی دروس پایه یازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه یازدهم
- فلش کارت های آماده دروس پایه یازدهم
- گنجینه ای جامع از انشاء های آماده پایه یازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه یازدهم
نحوه یافت عناصر در طبیعت
فصل 1 : قدر هدایای زمینی را بدانیم
نحوه یافت عناصر در طبیعت
یافته ها نشان می دهد كه اغلب عنصرها در طبیعت به شكل تركیب یافت می شوند، هرچند برخی نافلزها مانند اكسیژن، نیتروژن، گوگرد و... به شكل آزاد در طبیعت وجود دارند و وجود نمونه هایی از فلزهای نقره، مس، پلاتین نیز در طبیعت گزارش شده است. البته در میان فلزها، تنها طلا به شكل كلوخه ها یا رگه های زرد لا به لای خاک یافت می شود؛ آهن فلزی است كه در سطح جهان بیشترین مصرف سالانه را در بین صنایع گوناگون دارد. در كشور ما نیز مصرف آهن بسیار زیاد است. همانطور كه می دانید آهن اغلب در طبیعت به شكل اكسید یافت می شود.
شیمی دان ها با بررسی دقیق مواد، رفتار آنها را می شناسند تا پاسخ اینگونه پرسش ها را بیابند. یكی از حوزه های پركاربرد و اقتصادی علم شیمی، یافتن راه های گوناگون و مناسب برای استخراج و تولید عنصرها از طبیعت است.
واكنش پذیری هر فلز، تمایل آن را برای انجام واكنش شیمیایی نشان می دهد. هرچه فلز واكنش پذیرتر باشد، تمایل آن برای اجنام واكنش بیشتر است.
مثال
مشخص کنید کدام واکنش زیر (الف یا ب) انجام می شود؟ چرا؟
الف) \(FeO(s) + 2Na(s) \to \Delta \to N{a_2}O(s) + Fe(s)\)
(ب \(FeO(s) + Cu(s) \to \Delta \to Fe(s) + CuO(s)\)
الف انجام پذیر است زیرا فلز سدیم فعال تر از فلز آهن است و تمایل به تشکیل ترکیب در آن بیشتر است.
ب انجام پذیر نیست زیرا مس فعالیت کمتری در مقایسه با آهن دارد.
واكنش پذیری هر عنصر به معنای تمایل اتم آن به انجام واكنش شیمیایی است. هرچه واكنش پذیری اتم های عنصری بیشتر باشد، در شرایط یكسان تمایل آن برای تبدیل شدن به تركیب بیشتر است. هرچه فلز فعال تر باشد، میل بیشتری به ایجاد تركیب دارد و تركیب هایش پایدارتر از خودش است. به دیگر سخن هرچه واكنش پذیری فلزی بیشتر باشد، استخراج آن فلز دشوارتر است. فلزها از جمله هدایای زمینی هستند كه اغلب در طبیعت به شكل سنگ معدن یافت می شوند. در كشور ما فولاد مباركه، مس سرچشمه، آلومینیم اراک و منیزیم خراسان جنوبی از جمله مجتمع های صنعتی هستند كه برای استخراج فلزها بنا شده اند. اكنون می خواهیم بررسی كنیم چگونه می توان فلز \(Fe\) را از \(F{e_2}{O_3}\) استخراج كرد. برای انجام این كار می توان از واکنش \(F{e_2}{O_3}\) با فلز سدیم یا عنصر كربن بهره برد. از آنجا كه دسترسی به كربن آسان تر است و صرفه اقتصادی بیشتری دارد، در فولاد مباركه مانند همۀ شركت های فولاد جهان، برای استخراج آهن از كربن استفاده می شود. معادلۀ واكنشی كه منجر به تولید آهن می شود، به صورت زیر است:
\(2F{e_2}{O_3}(s) + 3C(s) \to \Delta \to 4Fe(s) + 3C{O_2}(g)\)
در شیمی دهم با روش محاسبۀ مقدار فراورده از مقدار مشخصی واكنش دهنده آشنا شدید. بر اساس همان روابط می توان حساب كرد كه به ازای مصرف مقدار معینی \(F{e_2}{O_3}\)تولید چه مقدار فلز آهن انتظار می رود.
مثال
با توجه به معادلۀ واكنش زیر و با مراجعه به جدول دورهای حساب كنید، از واکنش یک تن \(F{e_2}{O_3}\)با مقدار كافی از كربن، انتظار می رود چند تن آهن تولید شود؟
\(2F{e_2}{O_3}(s) + 3C(s) \to \Delta \to 4Fe(s) + 3C{O_2}(g)\)
\(?tonFe = 1tonF{e_2}{O_3} \times \frac{{1000Kg}}{{1ton}} \times \frac{{1000g}}{{1Kg}} \times \frac{{1molF{e_2}{O_3}}}{{160gF{e_2}{O_3}}} \times \frac{{4molFe}}{{2molF{e_2}{O_3}}} \times \frac{{56gFe}}{{1molFe}} \times \frac{{1Kg}}{{1000g}} \times \frac{{1ton}}{{1000Kg}} = 0/7tonFe\)
دنیای واقعی واکنش ها
فصل 1 : قدر هدایای زمینی را بدانیم
دنیای واقعی واکنش ها
شیمی دان ها باید روشی برای بیان میزان خلوص مواد واکنش دهنده، میزان كارایی و بازدۀ هر واكنش را پیدا كنند تا بتوانند محاسبه های كمی را دقیق و درست اجنام دهند. شیمی دان ها برای محاسبۀ مقدار واقعی فراوردۀ تولید شده در یک واكنش از مفهومی به نام بازده درصدی استفاده می کنند (كمیتی كه كارایی یک واكنش را نشان می دهد(.
به مقدار فراوردۀ مورد انتظار در هر واكنش، مقدار نظری و به مقدار فراورده ای كه در عمل به دست می آید، مقدار عملی می گویند.
واکنش های شیمیایی همیشه مطابق آنچه انتظار می رود پیش نمی روند، زیرا ممکن است واکنش دهنده ها ناخالص باشند یا ممكن است واکنش به طور کامل انجام نشود، حتی گاهی نیز همزمان با آن، واکنش های ناخواستۀ دیگری اجنام می شود. با این توصیف مقدار واقعی فراورده از مقدار مورد انتظار كمتر است. در واقع بازده درصدی واكنش های شیمیایی از صد كمتر است.
مثال
یكی از راه های تهیۀ سوخت سبز، استفاده از بقایای گیاهانی مانند نیشكر، سیب زمینی و ذرت است. واكنش بی هوازی تخمیر گلوكز، از جمله واكنش هایی است كه در این فرایند رخ می دهد.
\({C_6}{H_{12}}{O_6}(aq) \to 2{C_2}{H_5}OH(aq) + 2C{O_2}(g)\)
حساب كنید از تخمیر 1/5 تن گلوكز موجود در پسماندهای گیاهی، چند تن سوخت سبز )اتانول( تولید می شود؟ بازده واكنش را 80 درصد در نظر بگیرید.
نخست با توجه به معادله واكنش، باید محاسبه شود چند تن فراورده مورد انتظار است.
\(?ton{C_2}{H_5}OH = 1/5ton{C_6}{H_{12}}{O_6} \times \frac{{1000Kg}}{{1ton}} \times \frac{{1000g}}{{1Kg}} \times \frac{{1mol{C_6}{H_{12}}{O_6}}}{{180g{C_6}{H_{12}}{O_6}}} \times \frac{{2mol{C_2}{H_5}OH}}{{1mol{C_6}{H_{12}}{O_6}}} \times \frac{{46g{C_2}{H_5}OH}}{{1mol{C_2}{H_5}OH}} \times \frac{{1Kg}}{{1000g}} \times \frac{{1ton}}{{1000Kg}} = 0/77ton{C_2}{H_5}OH\)
بازده درصدی= عملی مقدارنظری/ مقدار ×100
\(80 = \frac{x}{{0/77}} \times 100 \to x = 0/62ton{C_2}{H_5}OH\)
از آهن مذاب تولید شده در واكنش ترمیت برای جوش دادن خطوط راه آهن استفاده می شود.
گنج های اعماق دریا
بستر اقیانوس ها منبعی غنی از منابع فلزی گوناگون است. منابعی که انسان به تازگی آن را کشف کرده است. به دلیل نیاز روزافزون جهان به منابع شیمیایی و کاهش میزان این منابع در سنگ کره، شیمیدان ها را بر آن داشت تا در جست و جوی منابع تازه باشند. این جست و جو از رازی پرده برداشت که نشان می داد گنجی عظیم در اعماق دریاها نهفته است. این گنج در برخی مناطق محتوی سولفید چندین فلز واسطه و در برخی مناطق دیگر به صورت کلوخه ها و پوسته هایی غنی از فلزهایی مانند منگنز، کبالت، آهن،نیکل، مس و ... یافت می شود غلظت بیشتر گونه های فلزی موجود در کف اقیانوس نسبت به ذخایر زمینی، بهره برداری از این منابع را نوید می دهد.
میلیون ها کلوخه در ناحیه ای از اقیانوس آرام در سطح بستر یا نیمه فرو رفته در بستر پراکنده شده است.
جریان فلز بین محیط زیست و جامعه
فصل 1 : قدر هدایای زمینی را بدانیم
جریان فلز بین محیط زیست و جامعه
طبیعت منشأ و منبع هدایای گران بهایی است كه خداوند مهربان آن را به انسان ارزانی داشته است. انسان نیز با بهره گیری از توانایی های وجودی خود كه آن را نیز خداوند به وی عطا كرده است، از این هدایا برای برآورده كردن نیازهای خود به شكل های گوناگون استفاده می كند. استخراج فلز از سنگ معدن آن یكی از این روش ها است. دیدید كه سالانه صدها میلیون تن فلز از دل زمنی استخراج می شود. سپس از این فلزها، ابزار، وسایل و مواد گوناگونی تهیه می شود. در شیمی دهم آموختید كه براساس توسعۀ پایدار باید در تولید یک ماده یا عرضه خدمات، همۀ هزینه ها و ملاحظه های اقتصادی، اجتماعی و زیست محیطی را در نظر گرفت. به طوری كه اگر مجموع هزینه های بهره برداری از یك معدن با در نظر گرفتن این ملاحظه ها، كمترین مقدار ممكن باشد، در آن صورت در مسیر پیشرفت پایدار حركت می كنیم؛ یعنی رفتارهای ما، آسیب كمتری به جامعه ای که در مسیر حفظ محیط زیست است، وارد می كند و ردپای زیست محیطی ما را كاهش می دهد. با این روند در استفادۀ درست از این هدایای زمینی و نگهداری آنها برای آیندگان موفق خواهیم شد.
جامعه ای در مسیر توسعه پایدار است كه اقتصاد آن شكوفا باشد، در عین حال به محیط زیست آسیب كمتری بزند و مردم به اخلاق آراسته و به خوشنامی معروف باشند.
ارزيابی چرخه عمر اصطلاحی است كه برای ارزيابی میزان تأثير يک فراورده بر روی محيط زيست در مدت طول عمر آن به كار می رود. اين ارزيابی شامل ارزيابی از چهار مرحله استخراج و توليد مواد خام برای توليد يک فراورده، توزیع، مصرف و دفع آن است. ارزيابی چرخه عمر شامل بررسی و ارزيابی ميزان آب و انرژی مصرفی، پايدار بودن فرایند تأمین مواد خام، ميزان زباله و پسماند ايجاد شده و سهم حمل و نقل در همه مراحل است.
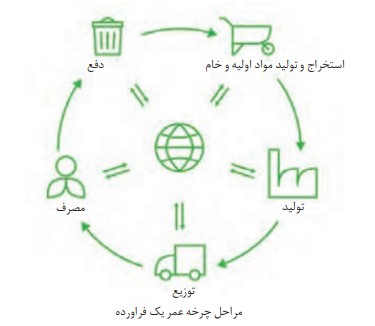
ارزيابی چرخه عمر حاصل تلاش برای يافتن شاخص هایی است که کمک می کنند صنايع گوناگون در مسير بهره گيری از دانش فنی و تخصصی سازگارتر با محيط زيست حرکت کنند و رفتار و عملکرد خود را در مسير رسيدن به توسعه پايدار اصلاح کنند.
- آزمون آنلاین تمامی دروس پایه یازدهم
- گام به گام تمامی دروس پایه یازدهم
- ویدئو های آموزشی تمامی دروس پایه یازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه یازدهم
- فلش کارت های آماده دروس پایه یازدهم
- گنجینه ای جامع از انشاء های آماده پایه یازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه یازدهم
نفت، هدیه ای شگفت انگیز
فصل 1 : قدر هدایای زمینی را بدانیم
نفت، هدیه ای شگفت انگیز
در اواخر سدۀ 18 میلادی شیمی دان ها با ماده ای روبه رو شدند كه رفتار آن به مواد شناخته شده تا آن زمان شبیه نبود؛ ماده ای كه بعدها نفت خام نامیده شد. این ماده یكی از سوخت های فسیلی است كه به شكل مایع غلیظ سیاه رنگ یا قهوه ای متمایل به سبز از دل زمین بیرون كشیده می شود.
نفت خام مخلوطی از هیدروکربن هاست.
امروزه نفت خام در دنیای كنونی دو نقش اساسی ایفا می كند. نقش نخست آن، منبع تأمین انرژی بوده و در نقش دوم، مادۀ اولیه برای تهیۀ بسیاری از مواد و كالاهایی است كه در صنایع گوناگون از آنها استفاده می شود.

موارد مصرف طلای سیاه
هر بشکه نفت خام هم ارز با 159 لیتر است.
پژوهش ها و یافته های تجربی نشان می دهد كه نفت خام، مخلوطی از هزاران تركیب شیمیایی است كه بخش عمدۀ آن را هیدروكربن های گوناگون تشكیل می دهند. تركیب هایی كه شامل هیدروژن و كربن هستند. از آنجا كه عنصر اصلی سازندۀ نفت خام كربن است، برای پی بردن به ویژگی ها و خواص مواد سازندۀ نفت خام ، نخست باید با رفتارها و ویژگی های اتم كربن آشنا شد.
کربن، اساس استخوان بندی هیدروکربن ها
فصل 1 : قدر هدایای زمینی را بدانیم
کربن، اساس استخوان بندی هیدروکربن ها
عنصر كربن در خانۀ شمارۀ 6 جدول دوره ای جای داشته و اتم آن در لایۀ ظرفیت خود چهار الكترون دارد. این اتم رفتارهای منحصر به فردی دارد كه آن را از اتم دیگر عنصرهای جدول متمایز می سازد. به طوریكه تركیب های شناخته شده از اتم كربن، از مجموع تركیب های شناخته شده از دیگر عنصرهای جدول دورهای بیشتر است.
اتم كربن می تواند الكترون هایش را با اتم های دیگر به اشتراک بگذارد و با رسیدن به آرایش هشت تایی، پایدار شود.
این رفتار كربن مشابه رفتار دیگر نافلزها (نیتروژن، فسفر، گوگرد و ...) است. برای مثال اتم نیتروژن \({}_7N\) سه پیوند اشتراکی تشكیل می دهد تا به آرایش هشت تایی برسد. اما تعداد تركیب های شناخته شده از آن محدود است.
اتم كربن افزون بر تشكیل پیوند اشتراکی یگانه، توانایی تشكیل پیوندهای اشتراکی دوگانه و سه گانه را با خود و برخی اتم های دیگر دارد.
كربن همچنین توانایی تشكیل زنجیر و حلقه های كربنی را دارد، به دیگر سخن اتم های كربن می توانند با پیوند اشتراکی به یكدیگر متصل شوند و زنجیرها و حلقه هایی در اندازه های گوناگون بسازند.
نفت خام مخلوطی شامل شمار زیادی از انواع هیدروكربن ها است. پنج نوع از هیدروكربن ها نشان داده شده است. در برخی از آنها، بین اتم های كربن فقط پیوندهای یگانه وجود دارد، درحالی كه برخی دیگر دارای یک پیوند سه گانه یا دارای یک یا چند پیوند دوگانه هستند. با توجه به ساختار متفاوت این هیدروكربن ها انتظار می رود كه رفتار آنها نیز با هم تفاوت داشته باشد.
البته اتم كربن می تواند با اتم عنصرهای هیدروژن، اكسیژن، نیتروژن و ... به شیوه های گوناگون متصل شده و مولکول شمار زیادی از مواد مانند كربوهیدرات ها، چربی ها، آمینواسیدها، آنزیم ها، پروتئین ها و... را بسازد. این ویژگی های كربن سبب شده تا از این عنصر تركیب های گوناگون و بسیار زیادی پدید آید. افزون بر این، اتم های كربن می توانند با یكدیگر به روش های گوناگون متصل شده و دگر شكل های متفاوتی مانند گرافیت، الماس و... ایجاد كنند.
آلکان ها
فصل 1 : قدر هدایای زمینی را بدانیم
آلکان ها
آلكان ها دسته ای از هیدروكربن ها هستند كه در آنها هر اتم كربن با چهار پیوند یگانه به اتم های كناری متصل شده است. متان (\(C{H_4}\)) ساده ترین و نخستین عضو خانوادۀ آلكان هاست. اعضای دیگر این خانواده شامل مولكول هایی است كه شمار اتم های كربن آنها از دو تا ده ها كربن متغیر است. اتم های كربن در ساختار آلكان ها می توانند پشت سرهم و همانند یک زنجیر به هم متصل شده باشند(شکل الف). هر چند كه برخی از آنها به شكل شاخۀ جانبی به زجنیر متصل می شوند (شکل ب). با این توصیف در هر آلكان راست زنجیر هر اتم كربن به یک یا دو اتم كربن دیگر متصل است، درحالی كه در آلكان شاخه دار، برخی كربن ها به سه یا چهار اتم كربن دیگر متصل اند.
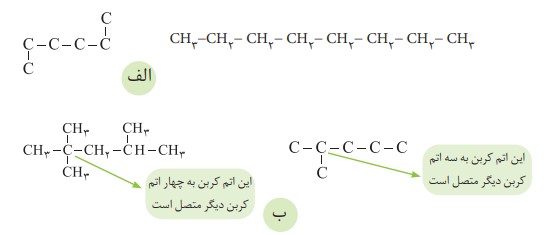
الف) دو نمونه آلكان راست زنجیر و ب) دو نمونه آلكان شاخه دار
هر یک از ساختارهای نشان داده شده در شكل، فرمول ساختاری آلكان مورد نظر را نشان می دهد. فرمولی كه در آن تعداد و چگونگی اتصال اتم های كربن و هیدروژن نمایش داده می شود. البته در نمایشی ساده تر، فرمول پیوند ــ خط را به كار می برند. در این فرمول، پیوند بین اتم های کربن را با خط تیره نشان می دهند اما اتم های کربن و هیدروژن نشان داده نمی شوند. برای نمونه:
شمار اتم های كربن نقش مهمی در رفتار هیدروكربن ها دارد. به طوری كه با تغییر تعداد اتم های كربن، اندازه و جرم مولكول های هیدروكربن تغییر می یابد و در پی آن نیروی بین مولكولی، نقطۀ جوش و... تغییر می كنند.
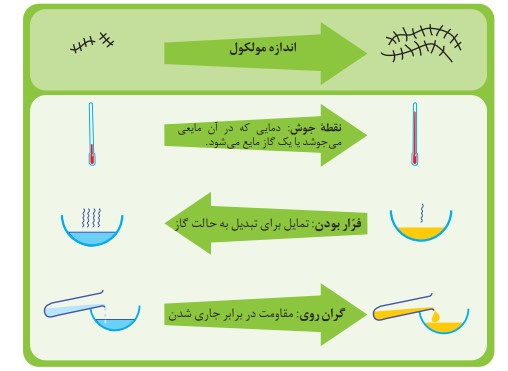
گریس (با فرمول تقریبی \({C_{18}}{H_{38}}\) )
وازلین (با فرمول تقریبی \({C_{25}}{H_{52}}\) )
آلكان ها به دلیل ناقطبی بودن در آب نامحلول اند. این ویژگی سبب می شود تا بتوان از آنها برای حفاظت از فلزها استفاده كرد. به طوری كه قرار دادن فلزها در آلكان های مایع یا اندود كردن سطح فلزها و وسایل فلزی با آنها، مانع از رسیدن آب به سطح فلز می شود و از خوردگی فلز جلوگیری می كند. ویژگی مهم و برجستۀ آلكان ها این است كه در ساختار آنها هر اتم كربن با چهار پیوند اشتراکی به چهار اتم دیگر متصل بوده و به اصطلاح سیرشده هستند. از این رو آلكان ها متایل چندانی به انجام واكنش های شیمیایی ندارند. این ویژگی سبب می شود تا میزان سمی بودن آنها كمتر شده و استنشاق آنها بر شش ها و بدن تأثیر چندانی نداشته باشد و تنها سبب كاهش مقدار اكسیژن در هوای دم می شوند. با وجود این هیچ گاه برای برداشتن بنزین از باک خودرو یا بشكه از مکیدن شیلنگ استفاده نكنید، زیرا بخارهای بنزین وارد شش ها شده و از انتقال گازهای تنفسی در شش ها جلوگیری می كند و نفس كشیدن دشوار می شود. اگر میزان بخارهای وارد شده به شش ها زیاد باشد، ممكن است سبب مرگ فرد شود. بنابراین هنگام كاركردن با این مواد باید نكات امینی را جدی بگیرید و رعایت كنید.
سوخت فندک، گاز بوتان بوده و تحت فشار پرشده است.
تجربه نشان می دهد كه گشتاور دو قطبی مولكول های سازندۀ چربی ها حدودصفر است. با توجه به آن:
الف) چرا افرادی كه با گریس كار می كنند دستشان را با بنزین یا نفت (مخلوطی از هیدروكربن ها) می شویند؟
زیرا گریس و بنزین و نفت از دسته آلکان ها هستند و گشتاور دوقطبی صفر و مولکول های ناقطبی دارند بنابراین طبق قاعده شبیه، شبیه را حل می کند، بنزین بعنوان حلال می تواند گریس را حل کند.
ب) توضیح دهید چرا پس از شستن دست با بنزین، پوست خشک می شود؟
چون بنزین بعنوان حلال، چربی روی پوست را در خود حل می کند .
پ) شستن پوست یا تماس آن با آلکان های مایع در دراز مدت به بافت های پوست آسیب می رساند. چرا؟
حل شدن چربی پوست در حلال های ناقطبی و خشک شدن مداوم پوست ، سبب ترک خوردگی پوست می شود و به بافت های پوست آسیب می رساند.
نام گذاری آلکان
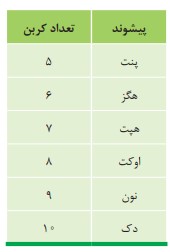
نام آلكان هایی مانند متان (\(C{H_4}\) )، اتان (\({C_2}{H_6}\) )، آشنا هستید. همانطور كه می بینید نام آلكان ها به پسوند (آن) ختم می شود. جدول زیر نام و فرمول مولكولی ده آلكان راست زنجیر را نشان می دهد.
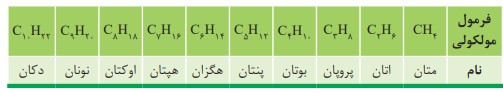
مطابق جدول بر اساس قواعد آیوپاک برای نامیدن آلكان راست زنجیر كافی است شمار اتم های كربن را با پیشوند معادل بیان كرده و پسوند (آن) را بیفزایید. توجه كنید كه در چهار عضو نخست آلكان ها، پیشوندی كه شمار اتم های كربن را معلوم كند، وجود ندارد و نام آنها براساس این روش انتخاب نشده است.
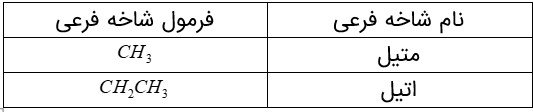
اما نامگذاری آلكان های شاخه دار كمی پیچیده تر است. از این رو آیوپاک قواعد بیشتری را برای نامیدن آلكان ها بنا نهاده است. در این قواعد چگونگی یافتن نوع و نام شاخه فرعی و جهت شماره گذاری زنجیر اصلی مشخص شده است.
مثال
نام دو آلكان زیر را در نظر بگیرید.
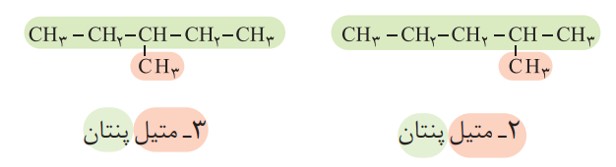
الف) هر عدد و هر واژه در نام هیدروكربن نشان دهندۀ چیست؟
هر عدد، شماره کربن زنجیر اصلی است که شاخه به آن متصل است، واژه متیل نام شاخه است و پنتان نام آلکان زنجیر کربنی است.
ب) تفاوت این دو ترکیب در چیست؟
موقعیت (محل اتصال) شاخه ها روی کربن زنجیر اصلی
برای نام گذاری آلكان ها باید نخست نام زنجیر اصلی را براساس نام آلكان راست زنجیر نوشته سپس نام شاخۀ فرعی را به صورت آلكیل پیش از نام زنجیر اصلی بنویسید. البته باید محل شاخۀ فرعی را با شمارۀ كربنی كه به آن متصل است، نیز پیش از نام شاخۀ فرعی مشخص كنید. برای نمونه، 4ـ متیل نونان، آلكانی با زنجیر اصلی نه كربنی را نشان می دهد كه به كربن شمارۀ 4 آن یك شاخۀ فرعی متیل متصل است.
مثال
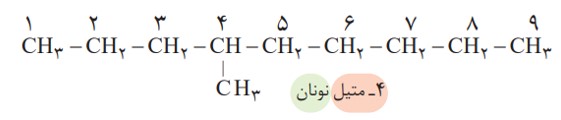
- آزمون آنلاین تمامی دروس پایه یازدهم
- گام به گام تمامی دروس پایه یازدهم
- ویدئو های آموزشی تمامی دروس پایه یازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه یازدهم
- فلش کارت های آماده دروس پایه یازدهم
- گنجینه ای جامع از انشاء های آماده پایه یازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه یازدهم
آلکن ها
فصل 1 : قدر هدایای زمینی را بدانیم
آلکن ها
این هیدروكربن ها در ساختار خود یک پیوند دوگانۀ كربن ــ كربن (C=C) دارند. برای نامگذاری آلكن های راست زنجیر، كافی است پسوند (آن) را در نام آلكان راست زنجیر بردارید و به جای آن پسوند (ــ ن) قرار دهید؛ سپس محل پیوند دوگانه را با شماره نخستین كربنی كه به پیوند دوگانه متصل است، مشخص كنید.
اتن نخستین عضو خانوادۀ آلكن هاست. این ماده در بیشتر گیاهان وجود دارد. موز و گوجه فرنگی رسیده گاز اتن آزاد می كنند. اتن آزاد شده از یک موز یا گوجه فرنگی رسیده به نوبه خود موجب رسیدن سریع تر میوه های نارس می شود. به همین دلیل در كشاورزی، از گاز اتن به عنوان (عمل آورنده) استفاده می شود.
در گذشته گاز اتن را با نام گاز اتیلن می خواندند.
رفتار آلكن ها همانند همۀ مواد به ساختار آنها وابسته است. وجود پیوند دوگانه در آلكن ها سبب شده است تا رفتار آنها با آلكان ها تفاوت زیادی پیدا كند. به گونه ای كه آلكن ها برخلاف آلكان ها، واكنش پذیری بیشتری دارند و در واكنش های گوناگونی شركت می كنند. واكنش پذیری زیاد آلكن ها به این دلیل است كه در ساختار آنها دو اتم كربن به سه اتم دیگر متصل بوده و از این رو (سیر نشده) هستند؛ این درحالی است که اتم كربن متایل دارد تا از حداكثر امكان خود برای تشكیل پیوندهای یگانه استفاده كند و چهار پیوند یگانه تشكیل دهد. گاز اتن سنگ بنای صنایع پتروشیمی است؛ زیرا در این صنایع با استفاده از اتن حجم انبوهی از مواد گوناگون تولید می شود. برای نمونه با واردكردن گاز اتن در مخلوط آب و اسید در شرایط مناسب، اتانول را در مقیاس صنعتی تولید می كنند. معادلۀ زیر، واكنش شیمیایی انجام شده را نشان می دهد.
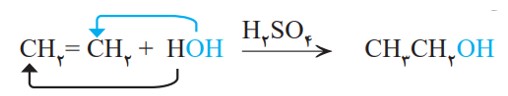
از مقایسۀ مولكول اتانول با مولكول اتن، در می یابید كه یكی از پیوندها میان اتم های كربن ــ كربن در مولكول اتن شكسته شده و به یكی از آن ها، اتم H و به دیگری، گروه OH متصل شده است. به دیگر سخن مولكول آب به اتم های كربن پیوند دوگانه افزوده شده و فراوردۀ سیرشده ای تولید شده است.
اتانول، الكلی دوكربنی، بی رنگ و فرار است كه به هر نسبتی در آب حل می شود. این الكل یكی از مهمترین حلال های صنعتی است كه در تهیه مواد دارویی، بهداشتی و آرایشی به كار می رود. از اتانول در بیمارستان ها به عنوان ضدعفونی كننده استفاده می شود.
از دیگر واكنش های گاز اتن، تركیب شدن آن با برم مایع است. به طوری كه هر گاه گاز اتن را در محلولی از برم وارد كنیم، رنگ قرمز محلول از بین می رود. این تغییر رنگ، نشانه انجام واكنش شیمیایی زیر است:
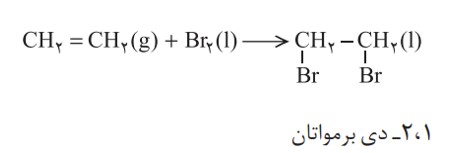
در این واكنش نیز، مولكول برم به پیوند دوگانۀ كربن ــ كربن در مولكول اتن افزوده می شود، و فراورده ای سیرشده پدید آمده است. همۀ آلكن ها در این واكنش شركت می كنند به گونه ای كه این واكنش یكی از روش های شناسایی آنها از هیدروكربن های سیرشده است.
صنعت پتروشیمی یكی از صنایع مهم جهان است. در این صنعت، تركیب ها و مواد گوناگون از نفت یا گاز طبیعی به دست می آیند كه به فراورده های پتروشیمیایی معروف هستند. در كشور ما نیز شركت های پتروشیمی گوناگونی در حال فعالیت هستند. در این شركت ها سالانه میلیون ها تن مواد شیمیایی مانند آمونیاک، پلی اتن، سولفوریک اسید و...تولید می شود.
پلیمری شدن دستۀ دیگری از واكنش آلكن هاست كه با استفاده از آن می توان انواع لاستیک ها، پلاستیک ها، الیاف و پلیمرهای سودمند را تهیه كرد.
آلکین ها
فصل 1 : قدر هدایای زمینی را بدانیم
آلکین ها
آیا واژۀ جوش کاربیدی را شنیده اید؟ در این جوشکاری از سوختن گاز اتین، دمای لازم برای جوش دادن قطعه های فلزی تأمین می شود. اتین هیدروکربنی است که در ساختار خود یک پیوند سه گانۀ کربن ــ کربن دارد.
به هیدروکربن های سیر نشده با یک پیوند سه گانۀ کربن ــ کربن، آلکین گفته می شود. برای نامگذاری آنها به جای پسوند (آن) در نام آلکان هم کربن، پسوند (ین) قرار می گیرد. اتین با فرمول مولکولی \({C_2}{H_2}\) ، ساده ترین آلکین و پروپین دومین عضو خانوادۀ آلکین ها است. از نام پروپین چنین برمی آید که هر مولکول آن سه کربن داشته و یک پیوند سه گانه میان دو کربن آن وجود دارد.
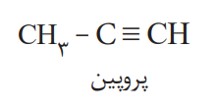
1 در گذشته گاز اتین را با نام گاز استیلن می خواندند.
2 آلکین ها نیز واکنش پذیری زیادی دارند و با مواد شیمیایی مختلف واکنش می دهند.
هیدروکربن های حلقوی
فصل 1 : قدر هدایای زمینی را بدانیم
هیدروکربن های حلقوی
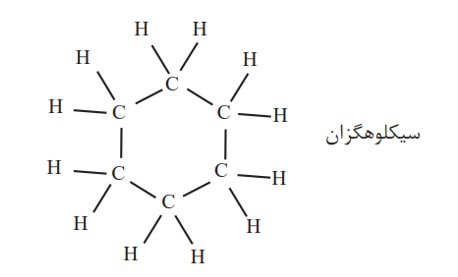
ترکیب های آلی بسیاری شناخته شده است که در آن ها اتم های کربن طوری به یکدیگر متصل شده اند که ساختاری حلقوی به وجود آورده اند. سیکلوهگزان از آن جمله است. این نام نشان می دهد که این ماده، هیدروکربن سیر شده ای است که حلقه ای از شش اتم کربن دارد.
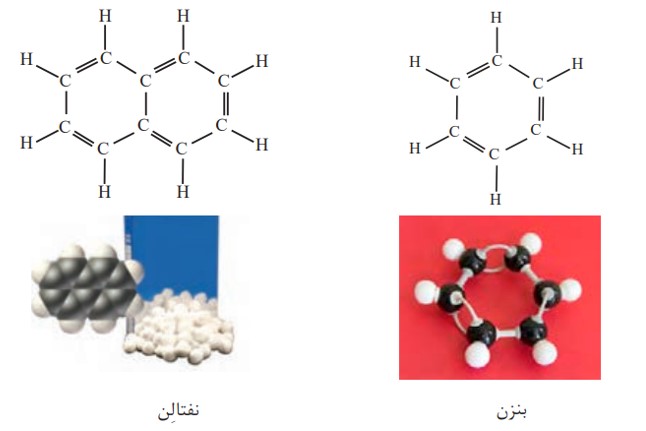
بنزن، هیدروکربنی سیرنشده با فرمول ساختاری زیر، سرگروه خانوادۀ مهمی از هیدروکربن ها به نام آروماتیک است. نفتالن نیز از جملۀ این ترکیب هاست. نفتالن مدت ها به عنوان ضدبید برای نگهداری فرش و لباس کاربرد داشته است.
- آزمون آنلاین تمامی دروس پایه یازدهم
- گام به گام تمامی دروس پایه یازدهم
- ویدئو های آموزشی تمامی دروس پایه یازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه یازدهم
- فلش کارت های آماده دروس پایه یازدهم
- گنجینه ای جامع از انشاء های آماده پایه یازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه یازدهم
نفت، متحول کننده جهان
فصل 1 : قدر هدایای زمینی را بدانیم
نفت، متحول کننده جهان
نفت خام مخلوطی از هیدروكربن های گوناگون، برخی نمک ها، اسیدها، آب و... است. البته مقدار نمک و اسید در نفت خام كم بوده و در نواحی گوناگون متغیر است. آلكان ها بخش عمدۀ هیدروكربن های موجود در نفت خام را تشكیل می دهند و به دلیل واكنش پذیری كم اغلب به عنوان سوخت به كار می روند، به طوری كه بیش از 90 درصد نفت خام صرف سوزاندن و تأمین انرژی می شود و تنها مقدار كمی از آن به عنوان خوراک پتروشیمی در تولید مواد پتروشیمیایی به كار می رود.
1 اندازه مولکول های نفت کوره بزرگتر است. هر چه مولکولی فرارتر باشد، جرم مولکول کمتر و بنابراین اندازه مولکول کوچک تر است.
2 هر چه درصد نفت کوره در نفتی بیشتر باشد آن نفت سنگین تر است و هر نفتی که خوراک پتروشیمی و بنزین بیشتری داشته باشد، نفت سبک تر است.
پس از جدا كردن نمك ها، اسیدها و آب، نفت خام را پالایش می كنند. درواقع با استفاده از تقطیر جزء به جزء، هیدروكربن های آن را به صورت مخلوط هایی با نقطۀجوش نزدیک به هم جدا می كنند. برای این كار، نفت خام را درون محفظه ای بزرگ گرما می دهند و آن را به برج تقطیر هدایت می كنند. برجی كه در آن از پایین به بالا دما كاهش می یابد. هنگامی كه نفت خام داغ به قسمت پایین برج وارد می شود، مولكول های سبک تر و فرارتر مواد پتروشیمیایی، از مایع بیرون آمده و به سوی بالای برج حركت می كنند. به تدریج كه این مولكول ها بالاتر می روند، سرد شده و به مایع تبدیل می شوند و در سینی هایی كه در فاصله های گوناگون برج قرار دارند وارد شده و از برج خارج می شوند. بدین ترتیب مخلوط هایی با نقطۀ جوش نزدیک به هم از نفت خام جداسازی می شوند. دستیابی به دانش و فناوری پالایش نفت خام، سبب ایجاد تحولی بزرگ در صنعت حمل و نقل، پتروشیمی و دیگر صنایع شد. پالایش نفت خام، از سویی سوخت ارزان و مناسب را در اختیار صنایع قرار می داد و از سوی دیگر، منجر به تولید انرژی الكتریكی ارزان قیمت می شد. همۀ این روند سبب شد تا ارزش و اهمیت طلای سیاه روز به روز بیشتر شود تا جایی كه استفاده و شناخت بیشتر آن، چهرۀ زندگی را آشكارا تغییر داد. این هدیۀ الهی در سدۀ گذشته كانون توجه و تحولات اجتماعی، سیاسی و اقتصادی در سطح جهان بود. اما استخراج و مصرف بی حساب این منبع خدادادی سبب شده تا این اندوخته رو به پایان باشد.
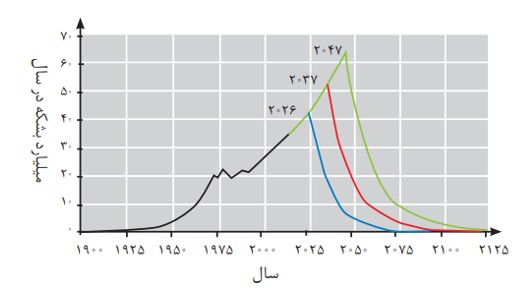
مقدار نفت خام تولید شده (خط سیاه) و برآورد شده (خطهای آبی، قرمز و سبز) خط آبی كمترین، خط سبز بیشترین و خط قرمز میانگین برآورد.
زغال سنگ یكی از سوخت های فسیلی است. برآوردها نشان می دهد كه طول عمر ذخایر زغال سنگ به 500 سال می رسد. از این رو زغال سنگ می تواند به عنوان سوخت، جایگزین نفت شود. اما جایگزینی نفت با زغال سنگ سبب ورود مقدار بیشتری از انواع آلاینده ها به هواكره شده و تشدید اثر گلخانه ای می شود.
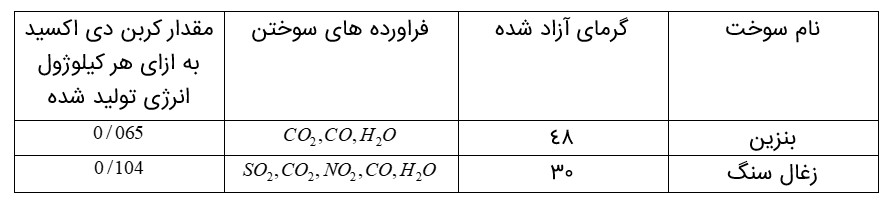
بنابراین باید به دنبال راه های بهبود كارایی زغال سنگ مانند موارد زیر باشیم.
شست و شوی زغال سنگ به منظور حذف گوگرد و ناخالصی های دیگر به دام انداختن گاز گوگرد دی اكسید خارج شده از نیروگاه ها با عبور گازهای خروجی از روی كلسیم اكسید
\(S{O_2}(g) + CaO(s) \to CaS{O_3}(s)\)
یكی از مشكلات زغال سنگ، شرایط دشوار استخراج آن است. به گونه ای كه در سده اخیر بیش از 500000 نفر در سطح جهان در اثر انفجار یا فروریختن معدن جان خود را از دست داده اند. این انفجارها اغلب به دلیل جتمع گاز متان آزاد شده از زغال سنگ در معدن رخ می دهد. متان گازی سبک، بی بو و بی رنگ است و هرگاه مقدار آن در هوای معدن به بیش از 5 درصد برسد، احتمال انفجار وجود دارد. البته با افزایش درصد متان تا مقدار معیین، همچنان احتمال انفجار وجود خواهد داشت. بنابراین ضروری است استانداردها و اصول ایمنی در معدن به طور دقیق رعایت و مقدار گاز متان در هوای معدن پیوسته اندازه گیری و کنترل شود. البته یكی از راه های كاهش متان در هوای معدن استفاده از تهویه مناسب و قوی است.
حمل و نقل هوایی سریع ترین حالت حمل و نقل بوده و مزایای آن مانند عدم نیاز به جاده سازی و تعمیرات آن، مسافرت آسان، خدمات رسانی خوب در مواقع اضطراری حتی در نقاط دوردست و ... است. اما به دلیل هزینۀ بسیار زیاد آن، برخی شرکت ها مانند پست و همچنین شمار محدودی از افراد جامعه می توانند از آن استفاده کنند. با وجود این مسئله، این صنعت روبه گسترش است و رقابت زیادی بین شرکت های هواپیمایی گوناگون در ساخت و بهره گیری از هواپیما وجود دارد. این روند اهمیت سوخت هواپیما را نشان می دهد. سوخت هواپیما از پالایش نفت خام در برج های تقطیر پالایشگاه ها تولید می شود. این سوخت به طور عمده از نفت سفید که مخلوطی از آلکان هاست تهیه می شود. امروزه تولید سوخت هواپیما یکی از صنایع مهم و ارزآور است که به دانش فنی بالایی نیز احتیاج دارد. از این رو شرکت های دانش بنیان می توانند با ورود به این عرصه کارآفرینی کرده و در شکوفایی اقتصاد کشور قدم های مؤثری را بردارند. یکی از مسائل مهم در تأمین سوخت، انتقال آن به مراکز توزیع و استفاده آن است که در حدود 66 درصد آن از طریق خطوط لوله و بقیه با استفاده از راه آهن، نفتکش جاده پیما و کشتی های نفتی انجام می شود.
نفت سفید شامل آلکان هایی با ده تا پانزده کربن است.
انرژی شیمیایی غذا
فصل 2 : در پی غذای سالم
انرژی شیمیایی غذا
غذا همواره نقش محوری در رشد، تندرستی و زندگی انسان داشته است. بررسی ها نشان می دهد كه نیاكان ما بیشتر وقت خود را صرف تهیه وعده های غذایی می كردند؛ آنچنان كه در طول روز اغلب در جست و جوی غذا و جمع آوری دانه های خوراكی بودند. آنها به تدریج یاد گرفتند كه دانه ها را بكارند و فراورد هها را درو كنند. فرایندی كه نخستین انقلاب در كشاورزی بود و باعث شد انسان ها حبوبات، غلات و... را به مقدار زیادی تولید كنند. اما افزایش جمعیت جهان عاملی تعیین كننده بوده و هست، به طوری كه امروزه تأمین غذای حدود 5/7 میلیارد نفر ساكن كرۀ زمین بسیار پیچیده و دشوار است، زیرا برای انجام این مهم سالانه بایستی حجم انبوهی از غلات، حبوبات، مواد پروتئینی و... تولید شود.
یكی از مهمترین و شاید دشوارترین مسئولیت هر دولت، تأمین غذای افراد جامعه است. مسئولیتی كه یكی از چالش های نگران كننده در عصر كنونی است.
برای تولید غذا در حجم انبوه به فعالیت های صنعتی گوناگونی مانند تولید، حمل و نقل، نگهداری، فراوری و... نیاز است؛ مجموعه حوزه هایی كه صنایع غذایی نامیده می شوند. در این صنعت نیز همانند دیگر صنایع منابع شیمیایی بسیاری، سطح وسیعی از زمین های بایر و حجم عظیمی از آب های قابل استفاده در كشاورزی مصرف می شود. این نیازها تأیید می كند كه یكی از مهمترین و شاید سنگین ترین مسئولیت های هر دولت، تأمین غذای افراد جامعه است. مسئولیتی كه در گذشته با قحطی و جنگ غذا تهدید می شد و امروزه نیز چالشی نگران كننده به شمار می رود.
1 پیشرفت دانش و فناوری موجب شده است که تولید فراورده های کشاورزی و دامی افزایش یابد و غذا به روش صنعتی تولید شود. در تولید انبوه، به دلیل فساد مواد غذایی و دشواری نگهداری آنها، حفظ کیفیت و ارزش مواد غذایی اهمیت بسزایی دارد.
2 گوشت قرمز و ماهی افزون بر پروتئین، محتوی انواع ویتامن و مواد معدنی است.
پژوهش ها و یافته های تجربی نشان می دهند كه مصرف غذا، انرژی مورد نیاز بدن برای حركت ماهیچه ها، ارسال پیام های عصبی، جا به جایی یون ها و مولكول ها از دیوارۀ هر یاخته را تأمین می كند. غذا همچنین مواد اولیه برای ساخت و رشد بخش های گوناگون بدن مانند سلول های خونی، استخوان، پوست، مو، ماهیچه ها، آنزیم ها و... را فراهم می كند. همۀ این فرایندها وابسته به انجام واكنش های شیمیایی هستند كه هر یک آهنگ ویژهای دارند؛ واكنش هایی كه دمای بدن را نیز كنترل و تنظیم می كنند. غذا به عنوان معجونی از مواد شیمیایی، محتوی ذره های گوناگون است. بخش عمدۀ اتم ها، مولكول ها و یون های موجود در بدن شما از غذایی كه می خورید، تأمین می شود. با این توصیف، تغذیۀ درست شامل وعده های غذایی است كه مخلوط مناسبی از انواع ذره ها را در برمی گیرد و سوء تغذیه هنگامی خودنمایی می كند كه وعده های غذایی با كمبود نوع خاصی از آنها همراه باشد. در این شرایط، بدن به تدریج ضعیف شده و شرایط بیماری فراهم خواهد شد. بدیهی است كه افزایش نامتناسب برخی مولكول ها و یون ها در وعده های غذایی سبب افزایش وزن و دیگر بیماری ها خواهد شد.
علم شیمی برای هر یک از این پرسش ها پاسخی دارد. گرماشیمی و سینتیک شیمیایی شاخه هایی از علم شیمی هستند كه می توان پاسخ پرسشهایی از این دست را در آنها جست و جو كرد.
بدن ما برای انجام فعالیت های ارادی و غیر ارادی گوناگون به ماده و انرژی نیاز دارد. برای نمونه هنگامی که قند خون پایین باشد می توان با خوردن سیب یا نوشیدن شربت آبلیمو و عسل و هنگامی که بدن دچار كمبود آهن باشد می توان با خوردن اسفناج و عدسی بدن را به حالت طبیعی بازگرداند. توجه كنید كه ارزش مواد غذایی در تأمین ماده و انرژی مورد نیاز بدن یكسان نیست.
یكی از راه های آزادشدن انرژی مواد، سوزاندن آنهاست. سوخت هایی مانند گاز شهری، بنزین، الكل و زغال هنگام سوخنت انرژی آزاد می كنند و این انرژی برای گرم كردن خانه، پخت و پز و نیز به حركت درآوردن خودروها مصرف می شود. همچنین مواد غذایی مانند ماكارونی و گردو نیز هنگام سوختن، انرژی آزاد می كنند. در واقع هر مادۀ غذایی انرژی دارد و میزان انرژی آن به جرمی بستگی دارد كه می سوزد، انرژی ای که می تواند باعث تغییر دما شود. اما اینكه دمای یک ماده چه چیزی را نشان می دهد و با انرژی چه رابطه ای دارد، هدفی است كه در ادامه دنبال خواهد شد.
دمای یک ماده نشانگر چیست؟
فصل 2 : در پی غذای سالم
دمای یک ماده نشانگر چیست؟
در شیمی بررسی ساختار مواد و فرایندها از دیدگاه ذره ای اهمیت و جایگاه ویژهای دارد.
هنگامی كه به ظرف محتوی آب گرما داده می شود، به تدریج دمای آن افزایش می یابد تا اینكه سرانجام آب می جوشد و یخ موجود در بالای آن نیز ذوب می شود. ذره های سازندۀ یک ماده در سه حالت فیزیكی یكسان بوده و پیوسته در جنب و جوش هستند اما میزان جنبش ذره ها متفاوت از یكدیگر است، به طوری كه جنبش های نامنظم ذره ها در حالت گاز شدیدتر از مایع و آن هم شدیدتر از حالت جامد است. همچنین هر چه دما بالاتر باشد، جنبش های نامنظم ذره های آن شدیدتر است. برای نمونه این جنبش ها در آب گرم شدیدتر از آب سرد است. گاز > مایع > جامد
با بررسی این تجربه اینک می پذیرید كه در دمای معین یک ویژگی مشترک مواد با هر حالت فیزیكی، وجود جنبش های نامنظم ذره های سازنده آنها است. هر چه دمای ماده بالاتر باشد، میانگین تندی و میانگین انرژی جنبشی ذره های سازنده آن بیشتر است. به دیگر سخن دمای یک ماده، معیاری برای توصیف میانگین تندی و میانگین انرژی جنبشی ذره های سازنده آن است.
مثال

اگر مجموع انرژی جنبشی ذره های سازنده یک نمونه ماده ، هم ارز با انرژی گرمایی آن باشد، انرژی گرمایی B بیشتر از A بوده، زیرا دمای آن بیشتر است.
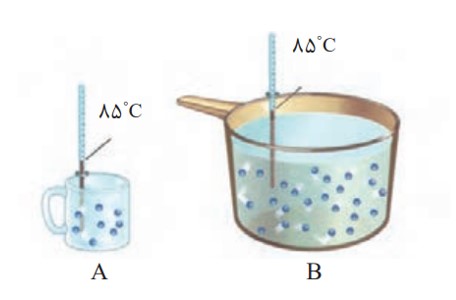
الف) میانگین تندی مولکول های آب را در دو ظرف مقایسه کنید.
میانگین تندی مولکول های به دما بستگی دارد و چون دما در دو ظرف یکسان است میانگین تندی برابر است.
ب) انرژی گرمایی آب موجود در کدام ظرف بیشتر است؟ چرا؟
B ، زیرا در ظرف B مقدار ماده بیش تر است. بنابراین مجموع انرژی گرمایی ذرات بیش تر است.
یكای رایج دما، درجه سلسیوس (\({C^0}\)(، در حالی كه یكای دما در (Si) كلوین (K) است.
نماد دما برحسب سلسیوس، (\(\theta \)) و نماد دما برحسب كلوین، (T) است.
اینک دما را كمیتی می دانید كه افزون بر میزان سردی و گرمی یک نمونه ماده، از میانگین تندی و میانگین انرژی جنبشی ذره های سازنده آن خبر می دهد.
انرژی گرمایی یک نمونه ماده، كمیتی است كه هم به دما و هم به جرم ماده بستگی دارد.
- آزمون آنلاین تمامی دروس پایه یازدهم
- گام به گام تمامی دروس پایه یازدهم
- ویدئو های آموزشی تمامی دروس پایه یازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه یازدهم
- فلش کارت های آماده دروس پایه یازدهم
- گنجینه ای جامع از انشاء های آماده پایه یازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه یازدهم
تفاوت دما و گرما
فصل 2 : در پی غذای سالم
تفاوت دما و گرما
از قبل می دانیم که گرما صورتی از انرژی است و دما مقیاسی است که میزان گرمی و سردی اجسام را نشان می دهد؛ ولی به طور دقیق تر دما و گرما چه مفهومی دارند؟
دمای هر ماده از جنب و جوش ذرات تشکیل دهنده آن ناشی می شود، بنابراین دما معیاری از دو ویژگی ذرات سازنده می باشد.
دما:
1) میانگین تندی ذرات
2) میانگین انرژی ذرات سازنده ماده
گرما: به مجموع انرژی جنبشی سازنده یک ماده گرما یا انرژی گرمایی می گویند.
انرژی ذرات = بخار آب > آب > یخ
فرمول محاسبه دمای یک جسم:
\(Q = m \times c \times \Delta \theta \)
که در این فرمول
Q = دما
M = جرم
C = گرمای ویژه
\(\Delta \theta \)= تغیرات دما
ظرفیت گرمایی (C): مقدار گرمایی که یک جسم می گیرد تا دمای آن \(1{}^0C\) افزایش یابد.
\(C = m \times c = \frac{Q}{{\Delta \theta }}\)
ظرفیت گرمایی ویژه (c): مقدار گرمایی که یک گرم جسم می گیرد تا دمای آن \(1{}^0C\) افزایش یابد.
\(c = \frac{Q}{{m \times \Delta \theta }}\)
روغن و چربی از جمله تركیب های آلی هستند كه به دلیل تفاوت در ساختار، رفتارهای فیزیكی و شیمیایی متفاوتی دارند. روغن دارای حالت فیزیكی مایع بوده اما چربی جامد است. از دیدگاه شیمیایی، در ساختار مولكول های روغن، پیوندهای دوگانه بیشتری وجود داشته و واكنش پذیری بیشتری نیز دارد.
جاری شدن انرژی گرمایی
فصل 2 : در پی غذای سالم
جاری شدن انرژی گرمایی
ابتدا تعاریف زیر را کامل می کنیم:
سامانه: بخشی از جهان است که با آن سر و کار داریم و آن را برسی می کنیم.
محیط: بخشی از جهان که با سامانه در ارتباط است.
انواع سامانه
1) باز: با محیط مبادله گرما و ماده دارد.
2) بسته: فقط مبادله انرژی (گرما) دارد.
3) منزوی: نه مبادله انرژی و نه مبادله ماده دارد.
سامانه
1) گرماده \(0\rangle h\)
2) گرماگیر \(0\langle h\)
مثال
یک لیوان در شرایط زیر است، مشخص کنید سامانه گرماگیر یا گرماده است.
الف) یک لیوان آب با دمای \(80{}^0C\) در دمای \(25{}^0C\) اتاق (گرماده)
ب) یک لیوان آب با دمای \(0{}^0C\) در دمای \(25{}^0C\) اتاق (گرماگیر)
ترموشیمی
فصل 2 : در پی غذای سالم
ترموشیمی
شاخه ای از علم شیمی است که درباره مبادله گرما در واکنش های شیمی و عوامل موثر بر آن بحث می کند. عواملی مانند: دما، حجم، فشار، حالت فیزیکی و .... .
در واکنش های ترموشیمی آرایش اتصال (نوع پیوند ها) تغییر می کند که موجب می شود گرما (انرژی) مبادله شود.انرژی پتانسیل شیمیایی در پیوند های شیمیایی نهفته است.
مفهوم آنتالپی: واکنش ها از لحاظ مبادله انرژی دو نوع هستند:
1) \(A \to B + q\) (گرماده)
2) \(q + A \to B\) (گرماگیر)
مبادله انرژی برای هر سامانه با محیط اطراف آن صورت می گیرد.
تعریف آنتالپی (H)
به محتوای انرژی یک ماده (سامانه) آنتالپی می گویند.
محتوای انرژی:
1) انرژی جنبشی ذرات سازنده
2) انرژی پتانسیل شیمیایی
هر ماده در دما و فشار معین آنتالپی مشخصی دارد.
آنتالپی (تغییر آنتالپی) \(\Delta H\): به مقدار گرمای مبادله شده در فشار ثابت آنتالپی می گویند.
\(\Delta H = {H_2} - {H_1}\)
در اینجا \({H_2}\) فراورده (پایانی) و \({H_1}\) واکنش دهنده (آغازی) است.
\(\Delta H\)فرایند های فیزیکی از قبل معلوم است.
0 < ذوب 0 > انجماد
0 < تبخیر 0 > میعان
0 < تصعید 0 > چگالش
\(\Delta H\) برخی از واکنش ها مانند سوختن معلوم است.
سوختن \(\Delta H\rangle 0\)
آنتالپی واکنش رفت و برگشت قرینه هستند.
آنتالپی پیوند
به مقدار گرمای مصرف شده برای شکستن یک مول پیوند و تبدیل آن به اتم های مجزا در حالت گازی، آنتالپی پیوند می گویند.
پیوند \(\Delta H\rangle 0\)
نکته
مقادیر \(\Delta H\)پیوند ها اندازه گیری شده و در کتاب آمده است.
آنتالپی تشکیل پیوند برعکس آنتالپی پیوند است.
محاسبه واکنش با استفاده از آنتالپی پیوند: واکنش های شیمیایی با شکستن و تشکیل پیوند های شیمیایی انجام می شوند.
واکنش \(\Delta H\)= (مجموع آنتالپی پیوند فرآورده) – (مجموع آنتالپی پیوند واکنش دهنده ها)
مثال
\(C{H_4} + {O_2} \to C{O_2} + 2{H_2}O\)
\(\Delta H\)= [(2×799)+(2×2×463)] – [(4×415)+(2×495)] = -800
- آزمون آنلاین تمامی دروس پایه یازدهم
- گام به گام تمامی دروس پایه یازدهم
- ویدئو های آموزشی تمامی دروس پایه یازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه یازدهم
- فلش کارت های آماده دروس پایه یازدهم
- گنجینه ای جامع از انشاء های آماده پایه یازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه یازدهم
گروه های عاملی
فصل 2 : در پی غذای سالم
گروه های عاملی
اتم یا گروهی از اتم ها هستند که به یک ترکیب آلی خواص فیزیکی و شیمیایی ویژه ای می بخشند.
1) گروه عاملی هیدروکسیل (-OH-)
نام ترکیب: الکل
نحوه نام گذاری: نام آلکان مربوطه + ول
\(C{H_3} - OH\) متانول
2) گروه عاملی اتری (--O)
نام ترکیب اتر
نحوه نام گذاری: نام شاخه ها + اتر
\(C{H_3} - O - C{H_3}\) دی متیل - اتر
3) گروه عاملی کربونیل 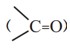
الف) کتون
نحوه نام گذاری: نام آلکان مربوطه + ون
ب) آلدهید
نحوه نام گذاری: نام آلکان مربوطه + آل
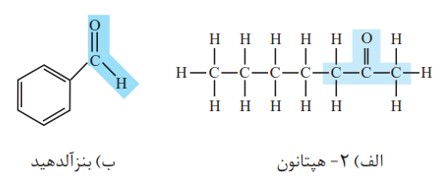
معروف ترین ترکیب کتون (استون) است.
آنتالپی سوختن
فصل 2 : در پی غذای سالم
آنتالپی سوختن
به مقدار گرمای آزاد شده از سوختن یک مول ماده در اکسیژن کافی آنتالپی سوختن می گویند.
\(\begin{array}{l}C{H_4} + 2{O_2} \to C{O_2} + 2{H_2}O + 890KJ\\{C_2}{H_6} + 7{O_2} \to 4C{O_2} + 6{H_2}O + 3120KJ\\\Delta H = \frac{{ - 3120}}{2} = - 1560\end{array}\)
ارزش سوختن: مقدار گرمای آزاد شده از سوختن یک گرم ماده در اکسیژن کافی را ارزش سوختن می گویند.
ارزش سوختن = مولی جرم/سوختن \(\Delta H\)
قانون هس
فصل 2 : در پی غذای سالم
قانون هس
اندازه گیری واکنش ها به دو صورت امکان پذیر است:
1) روش مستقیم (تجربی): از یک وسیله به نام گرماسنج لیوانی کمک می گیرند. اغلب برای واکنش هایی که در حالت محلول هستند به کار می رود.
\(Q = mc\Delta \theta = \Delta H\)
2) روش غیر مستقیم (قانون هس): گرمای همه واکنش ها را نمی توان مستیم اندازه گرفت زیرا برخی از واکنش ها پیچیده هستند، برخی از واکنش ها به سختی انجام می شوند.
مثال
\(\begin{array}{l}1)A + B \to C,\Delta {H_1} = - 100\\2)C \to X,\Delta {H_2} = 56\\3)A + B \to X,\Delta {H_3} = \Delta {H_1} + \Delta {H_2} = - 100 + 56 = - 44\end{array}\)
قانون هس: اگر معادله یک واکنش از جمع جبری چند واکنش دیگر بدست آید، مقدار \(\Delta H\) آن نیز از جمع جبری \(\Delta H\) واکنش ها بدست می آید.
مثال
\(\begin{array}{l}{F_2} + ClF \to Cl{F_3},\Delta H = ?\\1){O_2} + 2ClF \to C{l_2}O + O{F_2},\Delta {H_1} = 168 \to \div 2 \to 84\\2){O_2} + 2{F_2} \to 20{F_2},\Delta {H_2} = - 44 \to \div 2 \to - 22\\3)2Cl{F_3} + 2{O_2} \to C{l_2}O + 30{F_2},\Delta {H_3} = - 394 \to \div 2 \to - 197\\ \to \Delta H = \Delta {H_1} + \Delta {H_2} + \Delta {H_3} = 84 + ( - 22) + ( - 197) = - 135\end{array}\)
- آزمون آنلاین تمامی دروس پایه یازدهم
- گام به گام تمامی دروس پایه یازدهم
- ویدئو های آموزشی تمامی دروس پایه یازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه یازدهم
- فلش کارت های آماده دروس پایه یازدهم
- گنجینه ای جامع از انشاء های آماده پایه یازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه یازدهم
آهنگ واکنش
فصل 2 : در پی غذای سالم
آهنگ واکنش
آهنگ واکنش برابر است با تغییر شیمیایی بر زمان اما سرعت واکنش با آهنگ واکنش فرق دارد و برابر است با تغییر شیمیایی بر زمان معین، شیمیدانها آهنگ واكنش را در گستره معینی از زمان با نام سرعت واكنش بیان می كنند. سرعت وکنش می تواند به چهار دسته:
- بسیار سریع: انفجار
- سریع: رسوب
- کند: زنگ زدن اشیای آهنی
- بسیار کند: پوسیده شدن کاغذ
عوامل موثر بر سرعت واکنش
- ماهیت واکنش دهنده ها (برای هر واکنش ثابت بوده و تغییر نمی کند.)
- دما (با سرعت رابطه مستقیم دارد.)
- سطح تماس
- اثر غلظت (فشار)
- اثر کاتالیزگر
گروه عاملی کربوکسیل (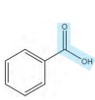 )
)
نام ترکیب: کربوکسیل اسید (اسید آلی)
نحوه نام گذاری: نام آلکان مربوطه + اِئوئیک اسید
معروف ترین ترکیب این گروه عاملی اتانوئیک اسید یا همان سرکه است.
سرعت واکنش
فصل 2 : در پی غذای سالم
سرعت واکنش
واکنش فرضی \(aA \to bB\) را در نظر می گیریم، ابتدا سرعت متوسط مصرف و تولید را برای اجزا محاسبه می کنیم.
\(\begin{array}{l}{R_A} = \frac{{{n_{2a}} - {n_{1a}}}}{{{t_2} - {t_1}}} = \frac{{\Delta {n_a}}}{{\Delta t}}\frac{{mol}}{{\min }}\\{R_B} = \frac{{{n_2}_b - {n_{1b}}}}{{{t_2} - {t_1}}} = \frac{{\Delta {n_b}}}{{\Delta t}}\frac{{mol}}{{\min }}\end{array}\)
نمودار مول – زمان و سرعت:
از روی شیب نمودار مول – زمان می توانیم سرعت متوسط را بدست آوریم.
شیب خط از فرمول \(\frac{{\Delta y}}{{\Delta x}}\) بدست می آید؛ که با قرار دادن \(\frac{{\Delta {n_{}}}}{{\Delta t}}\) به جای آن دو می توان سرعت واکنش را برحسب نمودار را پیدا کرد.
ارتباط بین \({R_A}\)و \({{R_B}}\): با استفاده از ضرایب استوکیومتری می توانیم نتیجه بگیریم که:
\(\frac{{{R_A}}}{a} = \frac{{{R_B}}}{b}\)
مثال
در واکنش زیر سرعت تولید X برابر \(0/02\frac{{mol}}{s}\) است. سرعت واکنش مصرف A و سرعت تولید Z را حساب کنید.
\(\begin{array}{l}2A \to 3X + 4Z\\ \to \frac{{{R_A}}}{2} = \frac{{{R_X}}}{3} = \frac{{{R_Z}}}{4} \to \frac{{{R_A}}}{2} = \frac{{0/02}}{3} \to {R_A} = \frac{{2 \times 0/02}}{3} = 0/013\frac{{mol}}{s}\\\frac{{{R_X}}}{3} = \frac{{{R_Z}}}{4} \to \frac{{{R_Z}}}{4} = \frac{{0/02}}{3} \to {R_Z} = \frac{{4 \times 0/02}}{3} = 0/026\frac{{mol}}{s}\end{array}\)
خوراکی های طبیعی بازدارنده
فصل 2 : در پی غذای سالم
خوراکی های طبیعی بازدارنده
یافته ها و شواهد تجربی نشان می دهد که برنامۀ غذایی محتوی سبزیجات و میوه های گوناگون، نقش بازدارندگی موثر در برابر سرطان ها و پیری زودرس دارند. این یافته ها دانشمندان و شیمی دان ها را بر آن داشت تا بررسی کنند چه موادی در سبزیجات و میوه ها این مهم را به عهده دارند. نتیجۀ پژوهش های علمی نشان داد که این خوراکی ها محتوی ترکیب های آلی سیرنشده ای به نام ریز مغذی ها هستند، ترکیب هایی که در حفظ سلامت بافت ها و اندام ها دخالت دارند، هر چند نقش کامل این مواد هنوز به طور دقیق مشخص نشده است اما برخی از آنها به عنوان بازدارنده از انجام واکنش نامطلوب و ناخواسته به دلیل حضور رادیکال ها جلوگیری می کنند. رادیکال، گونۀ فعال و ناپایداری است که در ساختار خود، الکترون جفت نشده دارد، در واقع محتوی اتم هایی است که از قاعدۀ هشت تایی پیروی نمی کنند. بدیهی است که رادیکال ها واکنش پذیری بالایی دارند. در بدن ما به دلیل انجام واکنش های متنوع و پیچیده، رادیکال هایی به وجود می آیند که اگر به وسیلۀ باز دارنده ها جذب نشوند، می توانند با انجام واکنش های سریع به بافت های بدن آسیب برسانند. با این توصیف مصرف خوراکی های محتوی بازدارنده ها سبب خواهد شد که رادیکال ها به دام بیفتند تا با کاهش مقدار آنها از سرعت واکنش های ناخواسته کاسته شود.
ویژگی رادیکال ها:
- ناپایدار
- پرانرژی
- واکنش پذیر
بازدارنده ها:
مولکول های بزرگ آلی هستند که غنی از الکترون بوده و فعالیت رادیکال هارا کاهش می دهد.
هندوانه و گوجه فرنگی محتوی لیکوپن بوده که فعالیت رادیکال ها را کاهش می دهد.
- آزمون آنلاین تمامی دروس پایه یازدهم
- گام به گام تمامی دروس پایه یازدهم
- ویدئو های آموزشی تمامی دروس پایه یازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه یازدهم
- فلش کارت های آماده دروس پایه یازدهم
- گنجینه ای جامع از انشاء های آماده پایه یازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه یازدهم
سرعت کل واکنش
فصل 2 : در پی غذای سالم
سرعت کل واکنش
سرعت کل واکنش از تقسیم واکنش دهنده ها یا فراورده ها بر ضریب، استوکیومتری حاصل می شود.
\(\begin{array}{l}2KCl{O_3} \to 2KCl + 3{O_3}\\R = \frac{{{R_{KCl{O_3}}}}}{2} = \frac{{KCl}}{2} = \frac{{{O_3}}}{3}\\R = \frac{{\Delta nKCl{O_3}}}{{2\Delta t}} = \frac{{\Delta nKCl}}{{2\Delta t}} = \frac{{\Delta n{O_3}}}{{3\Delta t}}\end{array}\)
مثال
سرعت واکنش زیر برابر \(0/8\frac{{mol}}{{\min }}\) می باشد. سرعت مصرف و تولید اجزای واکنش را بر حسب \(\frac{{mol}}{s}\) حساب کنید.
\(\begin{array}{l}2{H_2}{O_2} \to 2{H_2}O + {O_2}\\0/8\frac{{mol}}{{\min }} \times \frac{{1\min }}{{60s}} = 0/013\\\frac{{{R_{{H_2}{O_2}}}}}{2} = 0/013 \to {R_{{H_2}{O_2}}} = 0/026\frac{{mol}}{s}\\\frac{{{R_{{H_2}O}}}}{2} = 0/013 \to {R_{{H_2}O}} = 0/026\frac{{mol}}{s}\\\frac{{{R_{{O_2}}}}}{2} = 0/013 \to {R_{{O_2}}} = 0/013\frac{{mol}}{s}\end{array}\)
1 سمنو که از جوانه گندم تهیه می شود محتوی مواد غذایی گوناگونی از جمله مالتوز است.
2 برای شرکت کننده ها در فاز گاز و محلول، می توان سرعت متوسط مصرف یا تولید را افزون بر یکای مول بر زمان بایکای مول بر لیتر بر زمان نیز گزارش کرد.
3 غلظت مولی یک ماده را با نوشتن فرمول شیمیایی آن درون یک کروشه نمایش می دهند.
غذا، پسماند و ردپای آن
فصل 2 : در پی غذای سالم
غذا، پسماند و ردپای آن
زندگی ما و ادامۀ آن بر روی زمین به تأمین نیازهای ضروری مانند هوا، آب، غذا و... وابسته است. اما میزان نیاز و بهره مندی از این منابع برای همه یکسان نیست. دلیل این تفاوت را باید در سبک زندگی هر فرد جستجو کرد زیرا هر انسان در طول عمر خود، ردپاهای متفاوتی در محیط زیست برجای می گذارد. در شیمی دهم با ردپای کربن دی اکسید و آب آشنا شدید. ردپاهایی که دو چهرۀ آشکار و پنهان دارند. پدیدۀ دو چهرۀ دیگری از این دست، ردپای غذا است. چهرۀ آشکار آن نشان می دهد که سالانه حدود ٣0% غذایی که در جهان فراهم می شود به مصرف نمی رسد و به زباله تبدیل می شود و یا از بین می رود. این درحالی است که آمارها نشان می دهد که به ازای هر هفت نفر در جهان، یک نفر گرسنه است! خبری که هدر رفتن منابع اقتصادی را آشکار می سازد. اما چهرۀ پنهان این ردپا شامل همۀ منابعی است که در تهیۀ غذا از آغاز تا سر سفره سهم داشته اند. مدیریت منابع، نیروی انسانی برای تولید و تأمین مواد اولیه و انرژی، فراوری، ابزار و دستگاه های مورد نیاز، بسته بندی، حمل و نقل، آب و انرژی مصرفی، زمین های بایر و... از جمله این منابع هستند. چهرۀ پنهان این ردپا، تولید گازهای گلخانه ای به ویژه کربن دی اکسید است، آنچنان که سهم تولید این گاز در ردپای غذا به مراتب بیش از سوختن سوخت ها در خودروها، کارخانه ها و... است. از آنجا که جمعیت جهان، رشد اقتصادی، سطح رفاه و... رو به افزایش است، تقاضا برای غذا نیز پیوسته افزایش می یابد. تقاضایی که برای تأمین آن ،منابع آب، انرژی، مواد اولیه و زمنی بیشتری را می طلبد. بدیهی است که با این روند ردپای غذا روی محیط زیست سنگین تر شده و مساحت کل مورد نیاز برای تأمنی اقلام ضروری زندگی بیشتر خواهد شد. با توجه به الگوی تولید و مصرف غذا انتظار می رود مدیران جامعه جهانی با طراحی و انتخاب راه حل های اجرایی مناسب و هماهنگ، بهره وری را در مراحل تولید و تأمین غذا افزایش دهند تا ردپای آن کاهش یابد. آشکار است که اجرای هریک از این برنامه ها در گرو همت و تلاش یکایک ساکنان زمین است.
پوشاک
فصل 3 : پوشاک، نیازی پایان نا پذیر
پوشاک
انسان در طول تاریخ، همواره به دنبال تهیه پوشاک مناسب بوده است. پوشاک افزون بر پوشش بدن، در تمدن بشری نقش بزرگی داشته است آنچنان كه نوع پوشاک در هر قوم، توانایی و مهارت دستی، هنر، تصویرگری، دانش، فناوری و نیز آداب و رسوم آن نشان دهنده قوم است. پوشاک، بدن را در برابر عوامل محیطی گوناگون مانند سرما و گرما، نور خورشید، باران، تگرگ، گزند حشرات و... نیز محافظت می كند. برای مثال كلاه لبه دار، سر و صورت را در برابر تابش نور خورشید و آفتاب سوختگی و نیز پوشیدن كفش، پاها را در برابر خاک، سنگ، اشیای سخت، سردی و داغی زمین محافظت می كند.
با رشد و گسترش دانش و فناوری در صنایع و ایجاد نیازهای جدید و خاص، پوشاك گوناگونی مانند انواع كلاه ایمنی، كفش پنجه فولادی، عینک ایمنی و... تولید شد. پوشش هایی كه هر کدام ایمنی فیزیكی بدن را در شرایط دشوار و خطرناک به ویژه هنگام انجام فعالیت ها افزایش می دهد. به تازگی بشر با تكیه بر دانش و فناوری های نو توانسته است انواع تازهای از پوشاک تولید كند كه از بدن در برابر مواد شیمیایی مانند اسیدها، سموم، بخارهای سمی و غلیظ، پرتوها، آلودگی های عفونی، آتش، گلوله و... محافظت می كند.
انسان در گذشته پوشاک خود را از مواد طبیعی مانند پشم گوسفند و شتر، پوست و چرم، پنبه و... تهیه می كرد. با رشد جمعیت جهان، مصرف پوشاک به میزان چشمگیری افزایش یافت، به طوری كه روش های سنتی تولید پوشاک دیگر پاسخگوی نیازهای جامعه نبود.
به همین دلیل صنعت نساجی به شكل صنعتی و امروزی پدیدار شد، صنعتی كه با بهره گیری از فناوری های نو به تولید پوشاک پرداخت. اما موفقیت این صنعت در گرو تأمین الیاف مورد نیاز بود. از آنجا كه منابع طبیعی محدود بود، الیاف تولید شده پاسخگوی نیاز صنایع نساجی و جامعه نبود. گویی زمان آن رسیده بود كه شیمی دان ها طلای سیاه را به كار بگیرند و الیافی جدید تولید کرده و راهی شركت های نساجی كنند. با گذشت زمان تلاش شیمی دان ها نتیجه داد و در طول چند دهه، انواع گوناگونی از الیاف ساختگی بر پایۀ نفت، شناسایی و تولید شد؛ الیافی كه جایگزین الیاف طبیعی شد و امروزه بخش عمده پوشاک را تشكیل می دهد. آمارها نشان می دهند كه در سال 2014 میلادی نزدیک به صد میلیون تن انواع الیاف در جهان تولید و مصرف شده است.
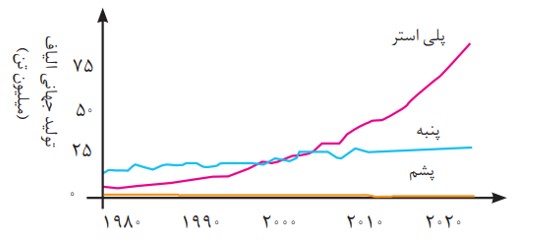
روند تولید الیاف پشمی، نخی و پلی استری در جهان
الیاف ساختگی، الیافی هستند كه در طبیعت یافت نمی شود بلكه از واكنش بین مواد شیمیایی در شركت های پتروشیمی تولید می شوند. در واقع اغلب فراورده های پتروشیمیایی برای تولید انواع گوناگون الیاف مانند پلی استر، نایلون و... به كار می روند. از این الیاف افزون بر تهیه پارچه و پوشاک، به طور گسترده ای در تهیه انواع پوشش ها، ظروف نچسب، یكبار مصرف و پلاستیكی، فرش، پرده و... استفاده می شود.
- آزمون آنلاین تمامی دروس پایه یازدهم
- گام به گام تمامی دروس پایه یازدهم
- ویدئو های آموزشی تمامی دروس پایه یازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه یازدهم
- فلش کارت های آماده دروس پایه یازدهم
- گنجینه ای جامع از انشاء های آماده پایه یازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه یازدهم
درشت مولکول ها
فصل 3 : پوشاک، نیازی پایان نا پذیر
درشت مولکول ها
پنبه یكی از الیاف طبیعی است كه در تولید پوشاک سهم قابل توجهی دارد. آمارها نشان می دهد كه حدود نیمی از لباس های تولیدی در جهان از پنبه تهیه می شود. از پنبه افزون بر تولید پوشاک در تولید رویۀ مبل، پرده، تور ماهیگیری، گاز استریل و... استفاده می شود. می دانید كه الیاف پنبه از سلولز تشكیل شده، زنجیری بسیار بلند كه از اتصال شمار بسیار زیادی مولكول گلوكز به یكدیگر ساخته می شود. با این توصیف شمار اتم های سازندۀ هر مولكول سلولز، بسیار زیاد بوده و اندازۀ مولكول آن بزرگ است.
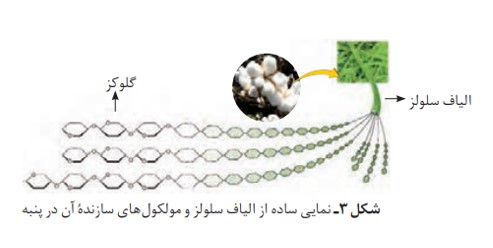
واژۀ پلیمر از واژۀ یونانی polys، به معنای (بسیار) و meros به معنای (پاره) گرفته شده است.
می دانید كه مادۀ مولكولی، ماده ای است كه ذره های سازندۀ آن مولكول ها هستند. برای مثال كربن دی اكسید (\(C{O_2}\))، برم (\(B{r_2}\))، متان (\(C{H_4}\))، آب(\({H_2}O\)) ، آمونیاک (\(N{H_3}\))، گوگرد تری اكسید (\(S{O_3}\))، هیدروكربن ها و... نمونه هایی از این تركیب ها هستند. این مولكول ها كوچک اند و شمار اتم های سازنده آنها كم، در نتیجه جرم مولی آنها کم تا متوسط است. درحالی كه مولكول برخی تركیب ها مانند سلولز، نشاسته و پروتئین موجود در پشم، ابریشم و... بسیار بزرگ است به طوری كه شمار اتم های آنها به ده ها هزار می رسد، از این رو به درشت مولكول معروف اند. درشت مولكول های دیگری مانند پلی اتن، نایلون، تفلون و... نیز وجود دارند كه در طبیعت یافت نمی شوند و ساختگی هستند. این مواد از واكنش پلیمری شدن )بسپارش) تهیه می شوند.
پلیمری شدن
فصل 3 : پوشاک، نیازی پایان نا پذیر
پلیمری شدن
پلیمری شدن واکنشی است که در آن مولكول های كوچک در شرایط مناسب به یكدیگر متصل می شوند و مولكول هایی با زنجیرهای بلند و جرم مولی زیاد تولید می كنند. برای نمونه هرگاه گاز اتن را در فشار بالا گرما دهیم، جامد سفیدرنگی به دست می آید. بررسی ها نشان می دهد که جرم مولی این فراورده، اغلب ده ها هزار گرم بر مول است. زیاد بودن جرم مولی بیانگر این است که در ساختار هر مولکول آن هزاران اتم کربن و هیدروژن وجود دارد. معادلۀ زیر واکنش شیمیایی انجام شده را توصیف می کند.
\(nC{H_2} = C{H_2}(g) \to H\& P \to {( - C{H_2} - C{H_2} - )_n}(s)\)
H&P به معنای گرما و فشار است.
در واکنش بالا طرف اول اتن و طرف دوم پلی اتن است.
با دقت در ساختار پلیاتن (فراورده) درمی یابید که هیدروکربنی سیر شده است زیرا هر اتم کربن در آن با چهار پیوند اشتراکی یگانه به چهار اتم دیگر متصل است، درحالی که در یک مولکول اتن هر اتم کربن به سه اتم دیگر متصل است. با این توصیف در طی این واکنش یکی از پیوندهای دوگانه در اتن شکسته شده و مولکول های اتن از سوی اتم های کربن به یکدیگر متصل می شوند. با ادامۀ این روند، شمار زیادی از مولکول های اتن به یکدیگر افزوده شده و مولکول هایی با زنجیر کربنی بلند ایجاد می شوند.
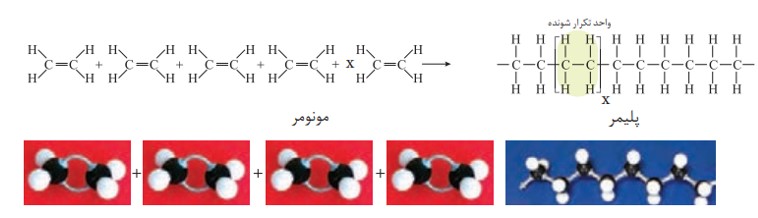
نمایی از واکنش تشکیل پلی اتن
به واکنش دهنده ها در واکنش پلیمری شدن، مونومر (تک پار) می گویند. در این واكنش ها شمار زیادی از مونومرها با یکدیگر واکنش می دهند و پلیمر را می سازند. مطابق شكل مونومرهای اتن به یکدیگر افزوده می شوند و پلی اتن را پدید می آورند. با دقت در ساختار پلی اتن در می یابید که این ترکیب از تکرار مجموعه ای از اتم های کربن و هیدروژن به نام واحد تکرار شونده پدید آمده است. توجه كنید كه تعیین تعداد دقیق مونومرهای شرکت کننده در یک واکنش پلیمری شدن ممكن نیست و تاكنون هیچ قاعده ای برای اتصال شمار مونومرها به یکدیگر ارائه نشده است. به همین دلیل برای پلیمرها نمی توان فرمول مولکولی دقیقی نوشت. شیمی دان ها برای نمایش آنها، واحد تکرار شونده را درون كمانک نوشته و زیروند n را جلوی آن می نویسند.
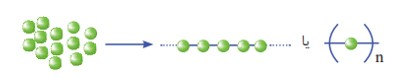
الگوی تشکیل یک پلیمر
بدیهی است كه براساس الگوی بالا با تغییر مونومر، پلیمری جدید با ساختار و خواص متفاوت می توان تهیه کرد.
به یاد داشته باشید هر ترکیب آلی که در ساختار خود پیوند دوگانۀ كربن ــ كربن در زنجیر كربنی داشته باشد، می تواند در این نوع واکنش پلیمری شدن شرکت کند. بر همین اساس، ترکیب های سیر نشده و حاوی چنین پیوندی در زنجیر كربنی می توانند در صنایع پتروشیمی با تأمین شرایط مناسب واکنش داده و پلیمرهای گوناگونی تولید کنند.
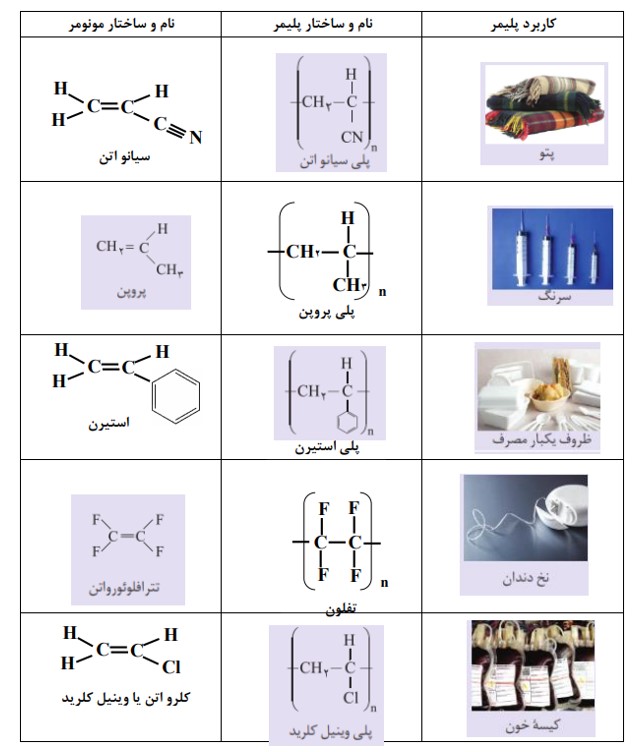
تفلون نام تجاری پلیمری است که کشف اتفاقی آن، پلانکت را به شهرت و ثروت رساند. ماجرا در دهه 1930 میلادی اتفاق افتاد. پلانکت و گروه پژوهشی او در حال بررسی و مطالعۀ انواع سردکننده ها بودند. یکی از گازهایی که آنها مصرف می کردند، تترافلوئورواتن بود. یک روز هنگامی که پلانکت شیر کپسول گاز را باز کرد، متوجه شد که گاز خارج نمی شود. او تصور کرد که مسیر خروج گاز بسته است، از این رو تلاش کرد تا مسیر را باز کند، اما هیچ چیز نبود و او تعجب کرد. کنجکاوی وی سبب شد موضوع را بیشتر پیگیری کند. پلانکت برای یافتن دلیل آن، جرم کپسول را اندازه گیری کرد و با نتیجۀ غیرمنتظره ای روبه رو شد. جرم کپسول مورد نظر با کپسول پر از گاز برابر بود! پافشاری وی برای حل مسئله، باعث شد تا او کپسول را برش دهد و داخل آن را مشاهده کند. او پس از برش کپسول با منظره تازه ای رو به رو شد. لایۀ نازکی از یک مادۀ جامد ته کپسول تشکیل شده بود. بررسی دقیق تر نشان داد که این مادۀ جامد از پلیمری شدن تترافلوئورواتن به دست آمده است.
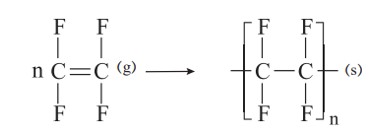
تفلون، نقطۀ ذوب بالایی دارد و در برابر گرما مقاوم است. این پلیمر از نظر شیمیایی بی اثر است و با مواد شیمیایی واكنش نمی دهد، در حلال های آلی حل نمی شود و نچسب است. این ویژگی ها دلیل كاربرد وسیع این پلیمر است.
پلی اتن یکی از مهم ترین پلیمرهای ساختگی است که سالانه میلیون ها تن از آن در شرکت های پتروشیمی تولید شده و برای ساخت وسایل گوناگون استفاده می شود.
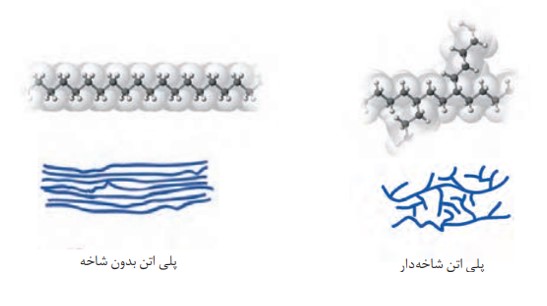
یافته های تجربی نشان داد که اتن در شرایط گوناگون، با انجام واکنش پلیمری شدن فراورده هایی با ساختار متفاوت پدید می آورد. نوعی پلی اتن، چگالی کمتری داشته و شفاف است، از این رو به پلی اتن سبک معروف است درحالی که پلی اتن سنگین، چگالی بیشتری داشته و کدر است.
مولکول های اتن می توانند به دو صورت به یکدیگر متفاوت ایجاد کنند. مولکول های اتن در شرایط معین پشت افزوده شوند و دو فراورده سرهم به یکدیگر متصل شده و زنجیرهای بلند و بدون شاخه ایجاد می شود. اما در شرایطی دیگر برخی مولکول های اتن از کناره ها به یکدیگر افزوده شده و زنجیرهای شاخه دار تولید می شود.
پلی استر
فصل 3 : پوشاک، نیازی پایان نا پذیر
پلی استر
شیمی دان ها با بررسی رفتار انواع مواد آلی، موفق به تهیه و ساخت پلیمرهایی شدند که در ساختار آنها اتم های اکسیژن و نیتروژن نیز وجود داشت. پلی استرها دست های از آنها هستند که از اتم های C، H و O تشکیل شده اند. از این پلیمرها می توان الیاف، نخ و در نهایت پارچه های پلی استری تولید کرد.
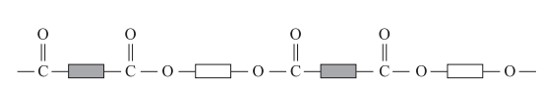
الگویی از ساختار پلی استرها
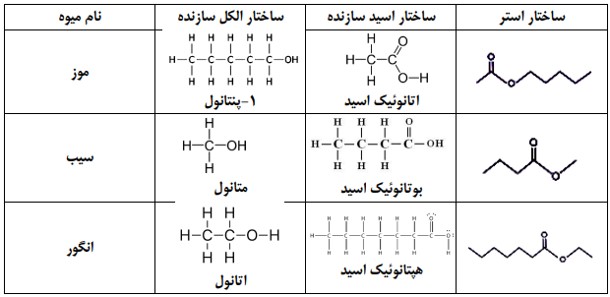
استرها دسته ای از مواد آلی هستند که منشأ بوی خوش شکوفه ها، گل ها، عطرها و نیز بو و طعم میوه ها هستند. برای نمونه، بو و طعم خوش آناناس به دلیل وجود اتیل بوتانوات در آن است.
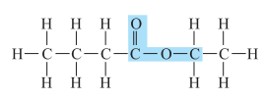
فرمول ساختاری اتیل بوتانوات
با دقت در ساختار مولکول استر در می یابید که به گروه عاملی آن دو بخش یا دو زنجیر هیدروکربنی متصل است. در یک سوی آن گروه هیدروکربنی به اتم اکسیژن و در سوی دیگر آن به اتم کربن این گروه متصل است.
گروه عاملی استری از واكنش یک الكل با یک كربوكسیلیک اسید ایجاد می شود.
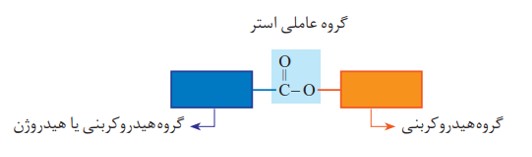
نمایش گروه عاملی استر
- آزمون آنلاین تمامی دروس پایه یازدهم
- گام به گام تمامی دروس پایه یازدهم
- ویدئو های آموزشی تمامی دروس پایه یازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه یازدهم
- فلش کارت های آماده دروس پایه یازدهم
- گنجینه ای جامع از انشاء های آماده پایه یازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه یازدهم
الکل ها و اسید ها
فصل 3 : پوشاک، نیازی پایان نا پذیر
الکل ها و اسید ها
الکل ها، ترکیب هایی هستند که در ساختار آنها یک یا چند گروه هیدروکسیل (OH-) با یک پیوند اشتراکی به اتم كربن متصل است. متانول و اتانول دو عضو خانوادۀ الكل های یک عاملی هستند.
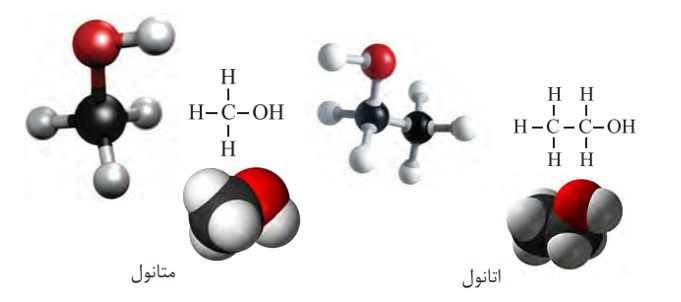
فرمول ساختاری، مدل فضاپركن و گلوله ــ میله برای متانول و اتانول
الكل های یک عاملی را می توان با فرمول ROH نشان داد كه در آن، R یک زنجیر هیدروكربنی است. كربوكسیلیک اسیدها نیز دسته ای دیگر از ترکیبهای آلی هستند که گروه عاملی کربوکسیل (COOH-) دارند. این تركیب ها مزۀ ترش دارند به طوری كه مزۀ ترش میوه هایی مانند انگور، لیمو ترش، كیوی، گوجه سبز و... ناشی از وجود چنین مولكول هایی در آن هاست. متانوئیک (فورمیک) اسید، HCOOH، اولین عضو خانوادۀ کربوکسیلیک اسیدهاست که بر اثر گزش مورچۀ سرخ وارد بدن شده و باعث سوزش و خارش در محل گزیدگی می شود. اتانوئیک اسید (استیک اسید) یک اسید دو كربنی است كه یکی از پرکاربردترین اسیدها در زندگی روزانه است
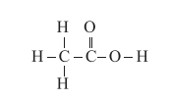
فرمول ساختاری استیک اسید
کربوکسیلیک اسیدهای یک عاملی را می توان با فرمول RCOOH یا 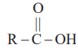 نشان که در آنR ، یک زنجیر هیدروکربنی یا هیدروژن است.
نشان که در آنR ، یک زنجیر هیدروکربنی یا هیدروژن است.
1 الکل های کوچک – تا سه اتم کربن به هر نسبت در آب حل می شوند.
2 تا 5 کربن محلول حساب می شوند.
3 همه آلکان ها، نا قطبی هستند.
4 با افزایش طول زنجیر هیدروكربنی در الكل ها، نیروی واندروالس بر هیدروژنی غلبه می كند و ویژگی ناقطبی الكل افزایش می یابد.
دریافتید که مولكول الكل ها دو بخش قطبی و ناقطبی دارد. زنجیر هیدروكربنی، بخش ناقطبی مولكول و گروه عاملی هیدروكسیل، بخش قطبی مولكول را تشكیل می دهد. بنابراین در الكل ها دو نوع نیروی بین مولكولی هیدروژنی و واندروالسی وجود دارد. به طوری كه در الكل های كوچک و تا پنج كربن، بخش قطبی بر ناقطبی غلبه دارد و الكل در آب محلول است. به دیگر سخن، نیروی بین مولكولی غالب در الكل ها تا پنج كربن از نوع هیدروژنی بوده و به همین دلیل به خوبی در آب حل می شوند. اما با افزایش شمار اتم های كربن، بخش ناقطبی مولكول بزرگتر شده و میزان قطبیت مولكول كاهش می یابد. این روند سبب می شود كه الكل های بزرگتر در آب حل نشوند بلكه در چربی حل شوند. از این رو ویژگی چربی دوستی الكل ها با افزایش شمار اتم های كربن، افزایش می یابد. به بیان دیگر، هرچه شمار اتم های کربن الکل ها بیشتر شود، ویژگی آب گریزی آنها افزایش می یابد.
1 ویتامین آ (A)، ویتامین دی (D) و ویتامین کا (K) ناقطبی هستند.
2 ویتامین ث (C) قطبی است.
در ترکیب های آلی مانند الکل ها و کربوکسیلیک اسیدها که دو بخش قطبی و ناقطبی دارند، با افزایش طول زنجیرکربنی بخش ناقطبی بزرگ تر می شود، قطبیت مولکول کاهش می یابد و انحلال پذیری آن در آب کمتر می شود.
واکنش استری شدن
فصل 3 : پوشاک، نیازی پایان نا پذیر
واکنش استری شدن
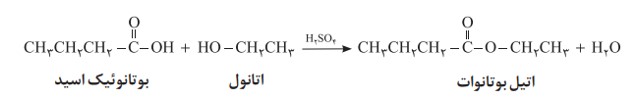
یکی از ویژگی های مهم و کاربردی کربوکسیلیک اسیدها و الکل ها، واکنش میان آنهاست. این مواد در شرایط مناسب واکنش می دهند و با از دست دادن آب، به استر تبدیل می شوند. معادله زیر واکنش شیمیایی انجام شده را توصیف می کند.
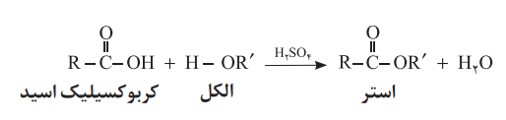
با این توصیف از واکنش استیک اسید با اتانول، طبق معادلۀ زیر اتیل استات به دست می آید.
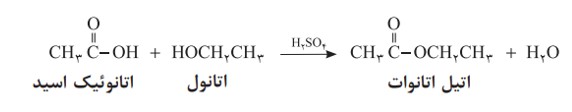
به همین ترتیب می توان اتیل بوتانوات را در مقیاس صنعتی تولید و از آن برای تولید شوینده با بوی آناناس استفاده کرد.
اكنون با توجه به واكنش استری شدن، می توان نتیجه گرفت كه از واكنش یک كربوكسیلیک اسید دوعاملی با یک الكل دو عاملی در شرایط مناسب، یك پلی استر تولید می شود. در مرحله نخست این واکنش، یكی از گروه های هیدروكسیل موجود در الكل با یكی از گروه های كربوكسیل موجود در اسید تركیب شده و با از دست دادن آب، گروه عاملی استری را ایجاد می كند.
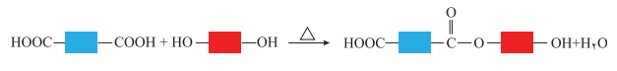
الگویی از واكنش استری شدن بین کربوکسیلیک اسید و الكل دو عاملی
همانطور كه در شكل بالا در ساختار فراورده، همچنان یک گروه عاملی هیدروكسیل و یک گروه عاملی كربوكسیل وجود دارد. این ساختار نوید می دهد كه واكنش استری شدن می تواند ادامه پیدا كند، آنچنان كه از یک سو با عامل اسیدی و از سوی دیگر با عامل الكلی در واكنش شرکت می کند. با ادامۀ این روند مولكول های بیشتر و بیشتری با یكدیگر واكنش می دهند و سرانجام مولكول هایی با زنجیر بلند و شمار زیادی عامل استری تشكیل می شود. فراورده ای كه پلی استر نامیده می شود.
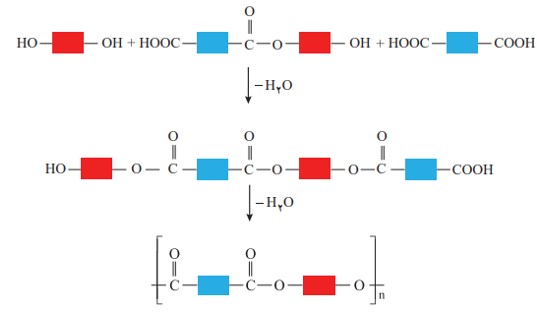
الگوی واکنش تشکیل پلی استر
رفتار و ویژگی های مواد به ساختار آنها بستگی دارد. بنابراین با استفاده از کربوکسیلیک اسیدها و الكل های دو عاملی گوناگون، پلی استرهایی با ساختار متفاوت و گوناگون می توان تهیه كرد. پلیمرهایی كه به دلیل داشتن خواص معین و منحصر به فرد، كاربرد های ویژه ای دارند. گوناگونی رفتار پلیمرها سبب شد تا شیمی دان های بیشتری به بررسی واكنش پلیمری شدن علاقه مند شوند. نتیجۀ این بررسی ها شناسایی دستۀ تازه ای از پلیمرها بود.
پلی آمید ها
فصل 3 : پوشاک، نیازی پایان نا پذیر
پلی آمید ها
پلیمرهای طبیعی زیادی شناسایی شده است كه در ساختار آنها اتم هایC ، H،O و N وجود دارد. مو، ناخن، پوست بدن ما همچنین شاخ حیوانات و پشم گوسفند نمونه ای از این پلیمرهای طبیعی هستند. در این دسته از پلیمرها گروه عاملی آمید 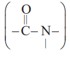 در طول زنجیر كربنی تكرار شده است.
در طول زنجیر كربنی تكرار شده است.
عامل آمیدی از واكنش اسید آلی با آمین به دست می آید. آمین، تركیبی آلی است كه در ساختار آن ها اتم هایC ، H وN وجود دارد. متیل آمین، ساده ترین آمین است. وجود اتم نیتروژن، خواص شیمیایی و فیزیكی منحصر به فردی به آمین ها داده است به طوری كه بوی ماهی ناشی از آمین های موجود در آن است.
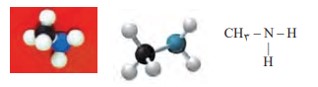
فرمول ساختاری، مدل گلوله ــ میله و فضا پرکن متیل آمن
واكنش تولید پلی آمید شبیه به تولید پلی استر است با این تفاوت كه به جای گروه عاملی الكل، گروه عاملی آمین با گروه کربوکسیل واكنش می دهد.
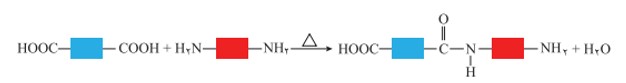
تشكیل گروه آمیدی
با ادامۀ واكنش، گروه های آمیدی بیشتری تشكیل شده و سرانجام پلی آمید تولید می شود.
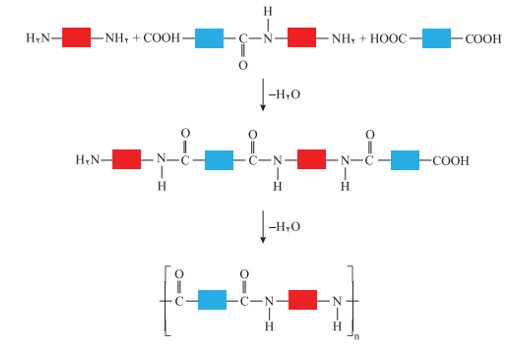
الگوی واكنش تشكیل پلی آمید
پلی آمیدهای ساختگی را در صنایع پتروشیمی از واكنش دی آمین ها با دی اسیدها تولید می كنند. كِولار یكی از معروف ترین پلی آمیدها است. این پلیمر از فولاد هم جرم خود پنج برابر مقاومتر است. از کولار در تهیه تایر اتومبیل، قایق بادبانی، لباس های مخصوص مسابقه موتورسواری و جلیقه های ضدگلوله استفاده می شود.
- آزمون آنلاین تمامی دروس پایه یازدهم
- گام به گام تمامی دروس پایه یازدهم
- ویدئو های آموزشی تمامی دروس پایه یازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه یازدهم
- فلش کارت های آماده دروس پایه یازدهم
- گنجینه ای جامع از انشاء های آماده پایه یازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه یازدهم
پلیمر ها، ماندگار یا تخریب پذیر
فصل 3 : پوشاک، نیازی پایان نا پذیر
پلیمر ها، ماندگار یا تخریب پذیر
نان و سیب زمینی از نشاسته غنی هستند. نشاسته، پلی ساكاریدی است كه از اتصال مولكول های گلوكز به یكدیگر تشكیل شده است. اگر نان را برای مدت طولانی تری در دهان بجوید، مزهای شیرین احساس خواهید كرد. سیب زمینی پخته نیز اندكی مزۀ شیرین دارد. این مزه شیرین ناشی از چیست؟
شیمی دان ها بر اساس یافته های تجربی دریافته اند كه مولكول های نشاسته در شرایط مناسب مانند محیط مرطوب با كاتالیزگر یا محیط گرم و مرطوب به آرامی به مونومرهای سازنده (گلوكز) تبدیل می شوند و مزه شیرین ایجاد می كنند. نشاسته هنگام گوارش (كه از دهان آغاز می شود) به گلوكز تبدیل می گردد. در واقع گوارش نشاسته شامل واكنش شیمیایی تبدیل آن است كه به كمک آنزیم ها تسریع می شود.
استرها نیز در شرایط مناسب با آب واكنش می دهند و به الكل و اسید آلی سازنده تبدیل می شوند.این واكنش به آبكافت استرها معروف است. برای نمونه معادلۀ زیر بعد آبكافت اتیل بوتانوات را نشان می دهد كه اتانول و بوتانوئیک اسید را تولید می كند.
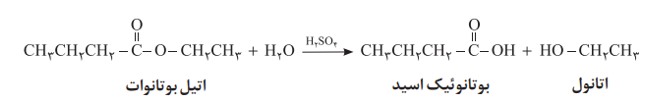
پلی آمیدها و پلی استرها نیز در شرایط مناسب با آب واكنش می دهند و به مونومرهای سازنده تبدیل می شوند.
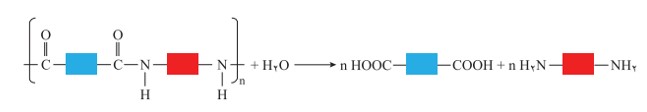
نمایی كلی از واكنش های تجزیه پلی آمید
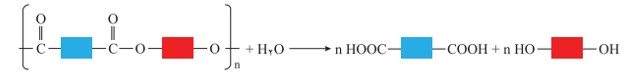
تجزیه پلی استر
با توجه به اینكه هر نوع پوشاک تاریخ مصرفی دارد می توان گفت پس از مدتی تار و پود آنها سست و پوسیده می شوند زیرا مولكول های پلیمر سازندۀ آنها با مولكول های موجود در محیط پیرامون واكنش می دهند و برخی از پیوندهای موجود در ساختار آنها مانند پیوند استری یا آمیدی شكسته می شوند. با شكستن این پیوندها، استحكام الیاف پارچه كم شده و تار و پود آن به سادگی گسسته می شود. بدیهی است كه هرچه آهنگ شكستن این پیوندها سریعتر باشد، فرایند پوسیده شدن پارچه سریعتر رخ می دهد.
مواد زیست تخریب پذیر موادی هستند كه در طبیعت توسط جانداران ذره بینی به مولكول های ساده و كوچک مانند كربن دی اكسید، متان، آب و... تبدیل می شوند. پلیمرهای طبیعی زیست تخریب پذیرند.
هرچند پلی استرها و پلی آمیدها شکسته می شوند، اما آهنگ این واکنش ها به ساختار مونومرهای سازنده بستگی دارد. بنابراین جنس لباس، در مدت زمان استفاده از آن مؤثر است. تجربه نشان می دهد كه به طور كلی واكنش آبکافت پلی استرها و پلی آمیدها كند است. به همین دلیل لباس های تهیه شده از این نوع پارچه ها برای مدت های طولانی قابل استفاده است زیرا استحكام خود را حفظ می كنند. این در حالی است كه پلیمرهای حاصل از هیدروكربن های سیرنشده، به انجام واكنش تمایلی ندارند و از این رو پوشاک و پوشش های تهیه شده از این مواد در طبیعت تجزیه نمی شوند و برای سالیان طولانی دست نخورده باقی می مانند. در واقع پلیمرهای ماندگارند. علت این است كه این پلیمرها، ساختاری شبیه به آلكان ها دارند و سیر شده هستند. هر چند استفاده از این پلیمرها صرفۀ اقتصادی دارد، اما از نگاه پیشرفت پایدار، تولید و استفاده از این پلیمرها الگوی مصرف مطلوبی نیست زیرا ماندگاری دراز مدت این مواد در طبیعت سبب ایجاد مشكلات فراوانی مانند تبدیل محیط زیست به گورستان زباله، كثیف شدن چهرۀ شهرها و محیط زیست، آسیب زدن به زندگی جانداران و... می شود كه هزینه های تحمیل شده به اقتصاد یك جامعه را خیلی بالا می برد. بدیهی است بازیافت این مواد یكی از راهكارهای عملی است كه به حفظ و بهره برداری بهینه از منابع منجر خواهد شد. به منظور آسان سازی و افزایش كارایی بازیافت و افزایش كیفیت فراورده های حاصل از بازیافت، برای هر پلیمر نشانه ای در نظر گرفته اند كه بر روی كالا ها حک می شود.
این نشانه شامل عددی است كه درون یک مثلث قرار دارد. جایگزینی پلیمرهای ساختگی با پایه نفتی با پلیمرهای زیست تخریب پذیر، راهكار دیگری است كه در دو دهه اخیر مورد توجه همه جهانیان قرار گرفته است.
پلیمر سبز
فصل 3 : پوشاک، نیازی پایان نا پذیر
پلیمر سبز
شیمی دان ها با انجام پژوهش های گسترده، موفق به ساخت دسته ای از پلیمرها شدند كه توسط جانداران ذره بینی تجزیه می شوند. هرگاه این پلیمرها و كالا های ساخته شده از آنها در طبیعت رها شوند، پس از چند ماه به مولكول های ساده مانند آب و كربن دی اكسید تبدیل می شوند. چنین پلیمرهایی دوستدار محیط زیست بوده و به پلیمرهای سبز معروف هستند. این پلیمرها را از فراورده های کشاورزی مانند سیب زمینی، ذرت و نیشكر تهیه می كنند. به طوری كه نخست نشاستۀ موجود در این مواد را به لاكتیک اسید تبدیل كرده سپس از واكنش پلیمری شدن آن در شرایط مناسب، پلی لاكتیک اسید تولید می كنند. از پلی لاكتیک اسید انواع ظرف های پلاستیكی یكبار مصرف مانند وسایل آشپزخانه، سفره، سطل زباله، كیسۀ پلاستیكی و... تولید شده و كاربرد آنها رو به گسترش است. این پلاستیك ها امکان تبدیل شدن به كود را دارند به همین دلیل ردپای كوچک تری در محیط زیست برجای می گذارند.
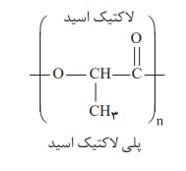
شیر ترش شده دارای لاکتیک اسید است.



1736019749.png)















