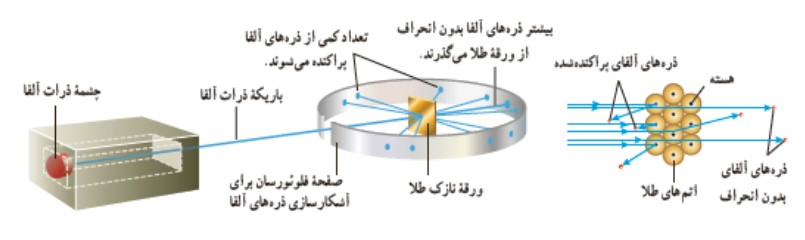
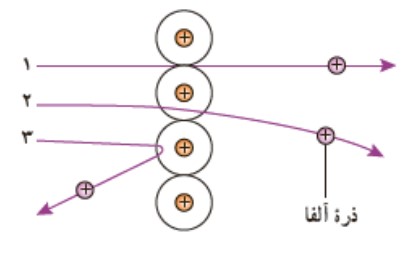
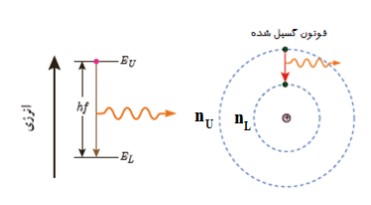
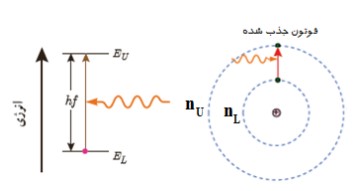
به زودی
این بخش به زودی راه اندازی می شود
به زودی
این بخش به زودی راه اندازی می شود
به وبسایت مای درس خوش آمدید
auto_awesome
grid_view
menu
dashboard
person



1736019749.png)












![[شاه کلید مای درس] | مدل های اتمی](https://dl.my-dars.com/upload/image/03 (7)1726189472.jpg)