درسنامه کامل شیمی یازدهم فصل 2 در پی غذای سالم
تعداد بازدید : 7.59Mخلاصه نکات شیمی یازدهم فصل 2 در پی غذای سالم - درسنامه شب امتحان شیمی یازدهم فصل 2 در پی غذای سالم - جزوه شب امتحان شیمی یازدهم نوبت اول فصل 2 در پی غذای سالم
انرژی شیمیایی غذا
انرژی شیمیایی غذا
غذا همواره نقش محوری در رشد، تندرستی و زندگی انسان داشته است. بررسی ها نشان می دهد كه نیاكان ما بیشتر وقت خود را صرف تهیه وعده های غذایی می كردند؛ آنچنان كه در طول روز اغلب در جست و جوی غذا و جمع آوری دانه های خوراكی بودند. آنها به تدریج یاد گرفتند كه دانه ها را بكارند و فراورد هها را درو كنند. فرایندی كه نخستین انقلاب در كشاورزی بود و باعث شد انسان ها حبوبات، غلات و... را به مقدار زیادی تولید كنند. اما افزایش جمعیت جهان عاملی تعیین كننده بوده و هست، به طوری كه امروزه تأمین غذای حدود 5/7 میلیارد نفر ساكن كرۀ زمین بسیار پیچیده و دشوار است، زیرا برای انجام این مهم سالانه بایستی حجم انبوهی از غلات، حبوبات، مواد پروتئینی و... تولید شود.
یكی از مهمترین و شاید دشوارترین مسئولیت هر دولت، تأمین غذای افراد جامعه است. مسئولیتی كه یكی از چالش های نگران كننده در عصر كنونی است.
برای تولید غذا در حجم انبوه به فعالیت های صنعتی گوناگونی مانند تولید، حمل و نقل، نگهداری، فراوری و... نیاز است؛ مجموعه حوزه هایی كه صنایع غذایی نامیده می شوند. در این صنعت نیز همانند دیگر صنایع منابع شیمیایی بسیاری، سطح وسیعی از زمین های بایر و حجم عظیمی از آب های قابل استفاده در كشاورزی مصرف می شود. این نیازها تأیید می كند كه یكی از مهمترین و شاید سنگین ترین مسئولیت های هر دولت، تأمین غذای افراد جامعه است. مسئولیتی كه در گذشته با قحطی و جنگ غذا تهدید می شد و امروزه نیز چالشی نگران كننده به شمار می رود.
1 پیشرفت دانش و فناوری موجب شده است که تولید فراورده های کشاورزی و دامی افزایش یابد و غذا به روش صنعتی تولید شود. در تولید انبوه، به دلیل فساد مواد غذایی و دشواری نگهداری آنها، حفظ کیفیت و ارزش مواد غذایی اهمیت بسزایی دارد.
2 گوشت قرمز و ماهی افزون بر پروتئین، محتوی انواع ویتامن و مواد معدنی است.
پژوهش ها و یافته های تجربی نشان می دهند كه مصرف غذا، انرژی مورد نیاز بدن برای حركت ماهیچه ها، ارسال پیام های عصبی، جا به جایی یون ها و مولكول ها از دیوارۀ هر یاخته را تأمین می كند. غذا همچنین مواد اولیه برای ساخت و رشد بخش های گوناگون بدن مانند سلول های خونی، استخوان، پوست، مو، ماهیچه ها، آنزیم ها و... را فراهم می كند. همۀ این فرایندها وابسته به انجام واكنش های شیمیایی هستند كه هر یک آهنگ ویژهای دارند؛ واكنش هایی كه دمای بدن را نیز كنترل و تنظیم می كنند. غذا به عنوان معجونی از مواد شیمیایی، محتوی ذره های گوناگون است. بخش عمدۀ اتم ها، مولكول ها و یون های موجود در بدن شما از غذایی كه می خورید، تأمین می شود. با این توصیف، تغذیۀ درست شامل وعده های غذایی است كه مخلوط مناسبی از انواع ذره ها را در برمی گیرد و سوء تغذیه هنگامی خودنمایی می كند كه وعده های غذایی با كمبود نوع خاصی از آنها همراه باشد. در این شرایط، بدن به تدریج ضعیف شده و شرایط بیماری فراهم خواهد شد. بدیهی است كه افزایش نامتناسب برخی مولكول ها و یون ها در وعده های غذایی سبب افزایش وزن و دیگر بیماری ها خواهد شد.
علم شیمی برای هر یک از این پرسش ها پاسخی دارد. گرماشیمی و سینتیک شیمیایی شاخه هایی از علم شیمی هستند كه می توان پاسخ پرسشهایی از این دست را در آنها جست و جو كرد.
بدن ما برای انجام فعالیت های ارادی و غیر ارادی گوناگون به ماده و انرژی نیاز دارد. برای نمونه هنگامی که قند خون پایین باشد می توان با خوردن سیب یا نوشیدن شربت آبلیمو و عسل و هنگامی که بدن دچار كمبود آهن باشد می توان با خوردن اسفناج و عدسی بدن را به حالت طبیعی بازگرداند. توجه كنید كه ارزش مواد غذایی در تأمین ماده و انرژی مورد نیاز بدن یكسان نیست.
یكی از راه های آزادشدن انرژی مواد، سوزاندن آنهاست. سوخت هایی مانند گاز شهری، بنزین، الكل و زغال هنگام سوخنت انرژی آزاد می كنند و این انرژی برای گرم كردن خانه، پخت و پز و نیز به حركت درآوردن خودروها مصرف می شود. همچنین مواد غذایی مانند ماكارونی و گردو نیز هنگام سوختن، انرژی آزاد می كنند. در واقع هر مادۀ غذایی انرژی دارد و میزان انرژی آن به جرمی بستگی دارد كه می سوزد، انرژی ای که می تواند باعث تغییر دما شود. اما اینكه دمای یک ماده چه چیزی را نشان می دهد و با انرژی چه رابطه ای دارد، هدفی است كه در ادامه دنبال خواهد شد.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه یازدهم- آزمون آنلاین تمامی دروس پایه یازدهم
- گام به گام تمامی دروس پایه یازدهم
- ویدئو های آموزشی تمامی دروس پایه یازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه یازدهم
- فلش کارت های آماده دروس پایه یازدهم
- گنجینه ای جامع از انشاء های آماده پایه یازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه یازدهم
دمای یک ماده نشانگر چیست؟
دمای یک ماده نشانگر چیست؟
در شیمی بررسی ساختار مواد و فرایندها از دیدگاه ذره ای اهمیت و جایگاه ویژهای دارد.
هنگامی كه به ظرف محتوی آب گرما داده می شود، به تدریج دمای آن افزایش می یابد تا اینكه سرانجام آب می جوشد و یخ موجود در بالای آن نیز ذوب می شود. ذره های سازندۀ یک ماده در سه حالت فیزیكی یكسان بوده و پیوسته در جنب و جوش هستند اما میزان جنبش ذره ها متفاوت از یكدیگر است، به طوری كه جنبش های نامنظم ذره ها در حالت گاز شدیدتر از مایع و آن هم شدیدتر از حالت جامد است. همچنین هر چه دما بالاتر باشد، جنبش های نامنظم ذره های آن شدیدتر است. برای نمونه این جنبش ها در آب گرم شدیدتر از آب سرد است. گاز > مایع > جامد
با بررسی این تجربه اینک می پذیرید كه در دمای معین یک ویژگی مشترک مواد با هر حالت فیزیكی، وجود جنبش های نامنظم ذره های سازنده آنها است. هر چه دمای ماده بالاتر باشد، میانگین تندی و میانگین انرژی جنبشی ذره های سازنده آن بیشتر است. به دیگر سخن دمای یک ماده، معیاری برای توصیف میانگین تندی و میانگین انرژی جنبشی ذره های سازنده آن است.
مثال

اگر مجموع انرژی جنبشی ذره های سازنده یک نمونه ماده ، هم ارز با انرژی گرمایی آن باشد، انرژی گرمایی B بیشتر از A بوده، زیرا دمای آن بیشتر است.
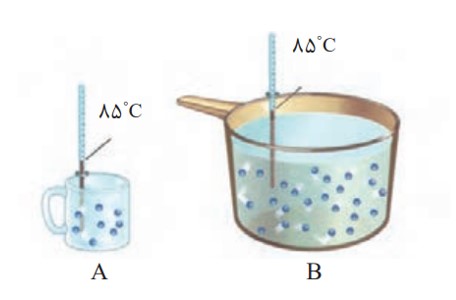
الف) میانگین تندی مولکول های آب را در دو ظرف مقایسه کنید.
میانگین تندی مولکول های به دما بستگی دارد و چون دما در دو ظرف یکسان است میانگین تندی برابر است.
ب) انرژی گرمایی آب موجود در کدام ظرف بیشتر است؟ چرا؟
B ، زیرا در ظرف B مقدار ماده بیش تر است. بنابراین مجموع انرژی گرمایی ذرات بیش تر است.
یكای رایج دما، درجه سلسیوس (\({C^0}\)(، در حالی كه یكای دما در (Si) كلوین (K) است.
نماد دما برحسب سلسیوس، (\(\theta \)) و نماد دما برحسب كلوین، (T) است.
اینک دما را كمیتی می دانید كه افزون بر میزان سردی و گرمی یک نمونه ماده، از میانگین تندی و میانگین انرژی جنبشی ذره های سازنده آن خبر می دهد.
انرژی گرمایی یک نمونه ماده، كمیتی است كه هم به دما و هم به جرم ماده بستگی دارد.
جزوات جامع پایه یازدهم
جزوه جامع شیمی یازدهم فصل 1 قدر هدایای زمینی را بدانیم
جزوه جامع شیمی یازدهم فصل 2 در پی غذای سالم
جزوه جامع شیمی یازدهم فصل 3 پوشاک، نیازی پایان نا پذیر
تفاوت دما و گرما
تفاوت دما و گرما
از قبل می دانیم که گرما صورتی از انرژی است و دما مقیاسی است که میزان گرمی و سردی اجسام را نشان می دهد؛ ولی به طور دقیق تر دما و گرما چه مفهومی دارند؟
دمای هر ماده از جنب و جوش ذرات تشکیل دهنده آن ناشی می شود، بنابراین دما معیاری از دو ویژگی ذرات سازنده می باشد.
دما:
1) میانگین تندی ذرات
2) میانگین انرژی ذرات سازنده ماده
گرما: به مجموع انرژی جنبشی سازنده یک ماده گرما یا انرژی گرمایی می گویند.
انرژی ذرات = بخار آب > آب > یخ
فرمول محاسبه دمای یک جسم:
\(Q = m \times c \times \Delta \theta \)
که در این فرمول
Q = دما
M = جرم
C = گرمای ویژه
\(\Delta \theta \)= تغیرات دما
ظرفیت گرمایی (C): مقدار گرمایی که یک جسم می گیرد تا دمای آن \(1{}^0C\) افزایش یابد.
\(C = m \times c = \frac{Q}{{\Delta \theta }}\)
ظرفیت گرمایی ویژه (c): مقدار گرمایی که یک گرم جسم می گیرد تا دمای آن \(1{}^0C\) افزایش یابد.
\(c = \frac{Q}{{m \times \Delta \theta }}\)
روغن و چربی از جمله تركیب های آلی هستند كه به دلیل تفاوت در ساختار، رفتارهای فیزیكی و شیمیایی متفاوتی دارند. روغن دارای حالت فیزیكی مایع بوده اما چربی جامد است. از دیدگاه شیمیایی، در ساختار مولكول های روغن، پیوندهای دوگانه بیشتری وجود داشته و واكنش پذیری بیشتری نیز دارد.
جاری شدن انرژی گرمایی
جاری شدن انرژی گرمایی
ابتدا تعاریف زیر را کامل می کنیم:
سامانه: بخشی از جهان است که با آن سر و کار داریم و آن را برسی می کنیم.
محیط: بخشی از جهان که با سامانه در ارتباط است.
انواع سامانه
1) باز: با محیط مبادله گرما و ماده دارد.
2) بسته: فقط مبادله انرژی (گرما) دارد.
3) منزوی: نه مبادله انرژی و نه مبادله ماده دارد.
سامانه
1) گرماده \(0\rangle h\)
2) گرماگیر \(0\langle h\)
مثال
یک لیوان در شرایط زیر است، مشخص کنید سامانه گرماگیر یا گرماده است.
الف) یک لیوان آب با دمای \(80{}^0C\) در دمای \(25{}^0C\) اتاق (گرماده)
ب) یک لیوان آب با دمای \(0{}^0C\) در دمای \(25{}^0C\) اتاق (گرماگیر)
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه یازدهم- آزمون آنلاین تمامی دروس پایه یازدهم
- گام به گام تمامی دروس پایه یازدهم
- ویدئو های آموزشی تمامی دروس پایه یازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه یازدهم
- فلش کارت های آماده دروس پایه یازدهم
- گنجینه ای جامع از انشاء های آماده پایه یازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه یازدهم
ترموشیمی
ترموشیمی
شاخه ای از علم شیمی است که درباره مبادله گرما در واکنش های شیمی و عوامل موثر بر آن بحث می کند. عواملی مانند: دما، حجم، فشار، حالت فیزیکی و .... .
در واکنش های ترموشیمی آرایش اتصال (نوع پیوند ها) تغییر می کند که موجب می شود گرما (انرژی) مبادله شود.انرژی پتانسیل شیمیایی در پیوند های شیمیایی نهفته است.
مفهوم آنتالپی: واکنش ها از لحاظ مبادله انرژی دو نوع هستند:
1) \(A \to B + q\) (گرماده)
2) \(q + A \to B\) (گرماگیر)
مبادله انرژی برای هر سامانه با محیط اطراف آن صورت می گیرد.
تعریف آنتالپی (H)
به محتوای انرژی یک ماده (سامانه) آنتالپی می گویند.
محتوای انرژی:
1) انرژی جنبشی ذرات سازنده
2) انرژی پتانسیل شیمیایی
هر ماده در دما و فشار معین آنتالپی مشخصی دارد.
آنتالپی (تغییر آنتالپی) \(\Delta H\): به مقدار گرمای مبادله شده در فشار ثابت آنتالپی می گویند.
\(\Delta H = {H_2} - {H_1}\)
در اینجا \({H_2}\) فراورده (پایانی) و \({H_1}\) واکنش دهنده (آغازی) است.
\(\Delta H\)فرایند های فیزیکی از قبل معلوم است.
0 < ذوب 0 > انجماد
0 < تبخیر 0 > میعان
0 < تصعید 0 > چگالش
\(\Delta H\) برخی از واکنش ها مانند سوختن معلوم است.
سوختن \(\Delta H\rangle 0\)
آنتالپی واکنش رفت و برگشت قرینه هستند.
آنتالپی پیوند
به مقدار گرمای مصرف شده برای شکستن یک مول پیوند و تبدیل آن به اتم های مجزا در حالت گازی، آنتالپی پیوند می گویند.
پیوند \(\Delta H\rangle 0\)
نکته
مقادیر \(\Delta H\)پیوند ها اندازه گیری شده و در کتاب آمده است.
آنتالپی تشکیل پیوند برعکس آنتالپی پیوند است.
محاسبه واکنش با استفاده از آنتالپی پیوند: واکنش های شیمیایی با شکستن و تشکیل پیوند های شیمیایی انجام می شوند.
واکنش \(\Delta H\)= (مجموع آنتالپی پیوند فرآورده) – (مجموع آنتالپی پیوند واکنش دهنده ها)
مثال
\(C{H_4} + {O_2} \to C{O_2} + 2{H_2}O\)
\(\Delta H\)= [(2×799)+(2×2×463)] – [(4×415)+(2×495)] = -800
جزوات جامع پایه یازدهم
جزوه جامع شیمی یازدهم فصل 1 قدر هدایای زمینی را بدانیم
جزوه جامع شیمی یازدهم فصل 2 در پی غذای سالم
جزوه جامع شیمی یازدهم فصل 3 پوشاک، نیازی پایان نا پذیر
گروه های عاملی
گروه های عاملی
اتم یا گروهی از اتم ها هستند که به یک ترکیب آلی خواص فیزیکی و شیمیایی ویژه ای می بخشند.
1) گروه عاملی هیدروکسیل (-OH-)
نام ترکیب: الکل
نحوه نام گذاری: نام آلکان مربوطه + ول
\(C{H_3} - OH\) متانول
2) گروه عاملی اتری (--O)
نام ترکیب اتر
نحوه نام گذاری: نام شاخه ها + اتر
\(C{H_3} - O - C{H_3}\) دی متیل - اتر
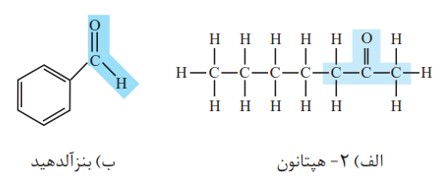
3) گروه عاملی کربونیل 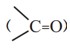
الف) کتون
نحوه نام گذاری: نام آلکان مربوطه + ون
ب) آلدهید
نحوه نام گذاری: نام آلکان مربوطه + آل
معروف ترین ترکیب کتون (استون) است.
آنتالپی سوختن
آنتالپی سوختن
به مقدار گرمای آزاد شده از سوختن یک مول ماده در اکسیژن کافی آنتالپی سوختن می گویند.
\(\begin{array}{l}C{H_4} + 2{O_2} \to C{O_2} + 2{H_2}O + 890KJ\\{C_2}{H_6} + 7{O_2} \to 4C{O_2} + 6{H_2}O + 3120KJ\\\Delta H = \frac{{ - 3120}}{2} = - 1560\end{array}\)
ارزش سوختن: مقدار گرمای آزاد شده از سوختن یک گرم ماده در اکسیژن کافی را ارزش سوختن می گویند.
ارزش سوختن = مولی جرم/سوختن \(\Delta H\)
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه یازدهم- آزمون آنلاین تمامی دروس پایه یازدهم
- گام به گام تمامی دروس پایه یازدهم
- ویدئو های آموزشی تمامی دروس پایه یازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه یازدهم
- فلش کارت های آماده دروس پایه یازدهم
- گنجینه ای جامع از انشاء های آماده پایه یازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه یازدهم
قانون هس
قانون هس
اندازه گیری واکنش ها به دو صورت امکان پذیر است:
1) روش مستقیم (تجربی): از یک وسیله به نام گرماسنج لیوانی کمک می گیرند. اغلب برای واکنش هایی که در حالت محلول هستند به کار می رود.
\(Q = mc\Delta \theta = \Delta H\)
2) روش غیر مستقیم (قانون هس): گرمای همه واکنش ها را نمی توان مستیم اندازه گرفت زیرا برخی از واکنش ها پیچیده هستند، برخی از واکنش ها به سختی انجام می شوند.
مثال
\(\begin{array}{l}1)A + B \to C,\Delta {H_1} = - 100\\2)C \to X,\Delta {H_2} = 56\\3)A + B \to X,\Delta {H_3} = \Delta {H_1} + \Delta {H_2} = - 100 + 56 = - 44\end{array}\)
قانون هس: اگر معادله یک واکنش از جمع جبری چند واکنش دیگر بدست آید، مقدار \(\Delta H\) آن نیز از جمع جبری \(\Delta H\) واکنش ها بدست می آید.
مثال
\(\begin{array}{l}{F_2} + ClF \to Cl{F_3},\Delta H = ?\\1){O_2} + 2ClF \to C{l_2}O + O{F_2},\Delta {H_1} = 168 \to \div 2 \to 84\\2){O_2} + 2{F_2} \to 20{F_2},\Delta {H_2} = - 44 \to \div 2 \to - 22\\3)2Cl{F_3} + 2{O_2} \to C{l_2}O + 30{F_2},\Delta {H_3} = - 394 \to \div 2 \to - 197\\ \to \Delta H = \Delta {H_1} + \Delta {H_2} + \Delta {H_3} = 84 + ( - 22) + ( - 197) = - 135\end{array}\)
جزوات جامع پایه یازدهم
جزوه جامع شیمی یازدهم فصل 1 قدر هدایای زمینی را بدانیم
جزوه جامع شیمی یازدهم فصل 2 در پی غذای سالم
جزوه جامع شیمی یازدهم فصل 3 پوشاک، نیازی پایان نا پذیر
آهنگ واکنش
آهنگ واکنش
آهنگ واکنش برابر است با تغییر شیمیایی بر زمان اما سرعت واکنش با آهنگ واکنش فرق دارد و برابر است با تغییر شیمیایی بر زمان معین، شیمیدانها آهنگ واكنش را در گستره معینی از زمان با نام سرعت واكنش بیان می كنند. سرعت وکنش می تواند به چهار دسته:
- بسیار سریع: انفجار
- سریع: رسوب
- کند: زنگ زدن اشیای آهنی
- بسیار کند: پوسیده شدن کاغذ
عوامل موثر بر سرعت واکنش
- ماهیت واکنش دهنده ها (برای هر واکنش ثابت بوده و تغییر نمی کند.)
- دما (با سرعت رابطه مستقیم دارد.)
- سطح تماس
- اثر غلظت (فشار)
- اثر کاتالیزگر
گروه عاملی کربوکسیل (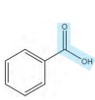 )
)
نام ترکیب: کربوکسیل اسید (اسید آلی)
نحوه نام گذاری: نام آلکان مربوطه + اِئوئیک اسید
معروف ترین ترکیب این گروه عاملی اتانوئیک اسید یا همان سرکه است.
سرعت واکنش
سرعت واکنش
واکنش فرضی \(aA \to bB\) را در نظر می گیریم، ابتدا سرعت متوسط مصرف و تولید را برای اجزا محاسبه می کنیم.
\(\begin{array}{l}{R_A} = \frac{{{n_{2a}} - {n_{1a}}}}{{{t_2} - {t_1}}} = \frac{{\Delta {n_a}}}{{\Delta t}}\frac{{mol}}{{\min }}\\{R_B} = \frac{{{n_2}_b - {n_{1b}}}}{{{t_2} - {t_1}}} = \frac{{\Delta {n_b}}}{{\Delta t}}\frac{{mol}}{{\min }}\end{array}\)
نمودار مول – زمان و سرعت:
از روی شیب نمودار مول – زمان می توانیم سرعت متوسط را بدست آوریم.
شیب خط از فرمول \(\frac{{\Delta y}}{{\Delta x}}\) بدست می آید؛ که با قرار دادن \(\frac{{\Delta {n_{}}}}{{\Delta t}}\) به جای آن دو می توان سرعت واکنش را برحسب نمودار را پیدا کرد.
ارتباط بین \({R_A}\)و \({{R_B}}\): با استفاده از ضرایب استوکیومتری می توانیم نتیجه بگیریم که:
\(\frac{{{R_A}}}{a} = \frac{{{R_B}}}{b}\)
مثال
در واکنش زیر سرعت تولید X برابر \(0/02\frac{{mol}}{s}\) است. سرعت واکنش مصرف A و سرعت تولید Z را حساب کنید.
\(\begin{array}{l}2A \to 3X + 4Z\\ \to \frac{{{R_A}}}{2} = \frac{{{R_X}}}{3} = \frac{{{R_Z}}}{4} \to \frac{{{R_A}}}{2} = \frac{{0/02}}{3} \to {R_A} = \frac{{2 \times 0/02}}{3} = 0/013\frac{{mol}}{s}\\\frac{{{R_X}}}{3} = \frac{{{R_Z}}}{4} \to \frac{{{R_Z}}}{4} = \frac{{0/02}}{3} \to {R_Z} = \frac{{4 \times 0/02}}{3} = 0/026\frac{{mol}}{s}\end{array}\)
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه یازدهم- آزمون آنلاین تمامی دروس پایه یازدهم
- گام به گام تمامی دروس پایه یازدهم
- ویدئو های آموزشی تمامی دروس پایه یازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه یازدهم
- فلش کارت های آماده دروس پایه یازدهم
- گنجینه ای جامع از انشاء های آماده پایه یازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه یازدهم
خوراکی های طبیعی بازدارنده
خوراکی های طبیعی بازدارنده
یافته ها و شواهد تجربی نشان می دهد که برنامۀ غذایی محتوی سبزیجات و میوه های گوناگون، نقش بازدارندگی موثر در برابر سرطان ها و پیری زودرس دارند. این یافته ها دانشمندان و شیمی دان ها را بر آن داشت تا بررسی کنند چه موادی در سبزیجات و میوه ها این مهم را به عهده دارند. نتیجۀ پژوهش های علمی نشان داد که این خوراکی ها محتوی ترکیب های آلی سیرنشده ای به نام ریز مغذی ها هستند، ترکیب هایی که در حفظ سلامت بافت ها و اندام ها دخالت دارند، هر چند نقش کامل این مواد هنوز به طور دقیق مشخص نشده است اما برخی از آنها به عنوان بازدارنده از انجام واکنش نامطلوب و ناخواسته به دلیل حضور رادیکال ها جلوگیری می کنند. رادیکال، گونۀ فعال و ناپایداری است که در ساختار خود، الکترون جفت نشده دارد، در واقع محتوی اتم هایی است که از قاعدۀ هشت تایی پیروی نمی کنند. بدیهی است که رادیکال ها واکنش پذیری بالایی دارند. در بدن ما به دلیل انجام واکنش های متنوع و پیچیده، رادیکال هایی به وجود می آیند که اگر به وسیلۀ باز دارنده ها جذب نشوند، می توانند با انجام واکنش های سریع به بافت های بدن آسیب برسانند. با این توصیف مصرف خوراکی های محتوی بازدارنده ها سبب خواهد شد که رادیکال ها به دام بیفتند تا با کاهش مقدار آنها از سرعت واکنش های ناخواسته کاسته شود.
ویژگی رادیکال ها:
- ناپایدار
- پرانرژی
- واکنش پذیر
بازدارنده ها:
مولکول های بزرگ آلی هستند که غنی از الکترون بوده و فعالیت رادیکال هارا کاهش می دهد.
هندوانه و گوجه فرنگی محتوی لیکوپن بوده که فعالیت رادیکال ها را کاهش می دهد.
جزوات جامع پایه یازدهم
جزوه جامع شیمی یازدهم فصل 1 قدر هدایای زمینی را بدانیم
جزوه جامع شیمی یازدهم فصل 2 در پی غذای سالم
جزوه جامع شیمی یازدهم فصل 3 پوشاک، نیازی پایان نا پذیر
سرعت کل واکنش
سرعت کل واکنش
سرعت کل واکنش از تقسیم واکنش دهنده ها یا فراورده ها بر ضریب، استوکیومتری حاصل می شود.
\(\begin{array}{l}2KCl{O_3} \to 2KCl + 3{O_3}\\R = \frac{{{R_{KCl{O_3}}}}}{2} = \frac{{KCl}}{2} = \frac{{{O_3}}}{3}\\R = \frac{{\Delta nKCl{O_3}}}{{2\Delta t}} = \frac{{\Delta nKCl}}{{2\Delta t}} = \frac{{\Delta n{O_3}}}{{3\Delta t}}\end{array}\)
مثال
سرعت واکنش زیر برابر \(0/8\frac{{mol}}{{\min }}\) می باشد. سرعت مصرف و تولید اجزای واکنش را بر حسب \(\frac{{mol}}{s}\) حساب کنید.
\(\begin{array}{l}2{H_2}{O_2} \to 2{H_2}O + {O_2}\\0/8\frac{{mol}}{{\min }} \times \frac{{1\min }}{{60s}} = 0/013\\\frac{{{R_{{H_2}{O_2}}}}}{2} = 0/013 \to {R_{{H_2}{O_2}}} = 0/026\frac{{mol}}{s}\\\frac{{{R_{{H_2}O}}}}{2} = 0/013 \to {R_{{H_2}O}} = 0/026\frac{{mol}}{s}\\\frac{{{R_{{O_2}}}}}{2} = 0/013 \to {R_{{O_2}}} = 0/013\frac{{mol}}{s}\end{array}\)
1 سمنو که از جوانه گندم تهیه می شود محتوی مواد غذایی گوناگونی از جمله مالتوز است.
2 برای شرکت کننده ها در فاز گاز و محلول، می توان سرعت متوسط مصرف یا تولید را افزون بر یکای مول بر زمان بایکای مول بر لیتر بر زمان نیز گزارش کرد.
3 غلظت مولی یک ماده را با نوشتن فرمول شیمیایی آن درون یک کروشه نمایش می دهند.
غذا، پسماند و ردپای آن
غذا، پسماند و ردپای آن
زندگی ما و ادامۀ آن بر روی زمین به تأمین نیازهای ضروری مانند هوا، آب، غذا و... وابسته است. اما میزان نیاز و بهره مندی از این منابع برای همه یکسان نیست. دلیل این تفاوت را باید در سبک زندگی هر فرد جستجو کرد زیرا هر انسان در طول عمر خود، ردپاهای متفاوتی در محیط زیست برجای می گذارد. در شیمی دهم با ردپای کربن دی اکسید و آب آشنا شدید. ردپاهایی که دو چهرۀ آشکار و پنهان دارند. پدیدۀ دو چهرۀ دیگری از این دست، ردپای غذا است. چهرۀ آشکار آن نشان می دهد که سالانه حدود ٣0% غذایی که در جهان فراهم می شود به مصرف نمی رسد و به زباله تبدیل می شود و یا از بین می رود. این درحالی است که آمارها نشان می دهد که به ازای هر هفت نفر در جهان، یک نفر گرسنه است! خبری که هدر رفتن منابع اقتصادی را آشکار می سازد. اما چهرۀ پنهان این ردپا شامل همۀ منابعی است که در تهیۀ غذا از آغاز تا سر سفره سهم داشته اند. مدیریت منابع، نیروی انسانی برای تولید و تأمین مواد اولیه و انرژی، فراوری، ابزار و دستگاه های مورد نیاز، بسته بندی، حمل و نقل، آب و انرژی مصرفی، زمین های بایر و... از جمله این منابع هستند. چهرۀ پنهان این ردپا، تولید گازهای گلخانه ای به ویژه کربن دی اکسید است، آنچنان که سهم تولید این گاز در ردپای غذا به مراتب بیش از سوختن سوخت ها در خودروها، کارخانه ها و... است. از آنجا که جمعیت جهان، رشد اقتصادی، سطح رفاه و... رو به افزایش است، تقاضا برای غذا نیز پیوسته افزایش می یابد. تقاضایی که برای تأمین آن ،منابع آب، انرژی، مواد اولیه و زمنی بیشتری را می طلبد. بدیهی است که با این روند ردپای غذا روی محیط زیست سنگین تر شده و مساحت کل مورد نیاز برای تأمنی اقلام ضروری زندگی بیشتر خواهد شد. با توجه به الگوی تولید و مصرف غذا انتظار می رود مدیران جامعه جهانی با طراحی و انتخاب راه حل های اجرایی مناسب و هماهنگ، بهره وری را در مراحل تولید و تأمین غذا افزایش دهند تا ردپای آن کاهش یابد. آشکار است که اجرای هریک از این برنامه ها در گرو همت و تلاش یکایک ساکنان زمین است.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه یازدهم- آزمون آنلاین تمامی دروس پایه یازدهم
- گام به گام تمامی دروس پایه یازدهم
- ویدئو های آموزشی تمامی دروس پایه یازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه یازدهم
- فلش کارت های آماده دروس پایه یازدهم
- گنجینه ای جامع از انشاء های آماده پایه یازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه یازدهم



1736019749.png)















