جواب تمرین های دوره ای صفحه 33 درس 1 شیمی دوازدهم (مولکول ها در خدمت تندرستی)
تعداد بازدید : 86.4Mپاسخ تمرین های دوره ای صفحه 33 شیمی دوازدهم
-گام به گام تمرین های دوره ای صفحه 33 درس مولکول ها در خدمت تندرستی
-تمرین های دوره ای صفحه 33 درس 1
-شما در حال مشاهده جواب تمرین های دوره ای صفحه 33 شیمی دوازدهم هستید. ما در تیم مای درس، پاسخنامههای کاملاً تشریحی و استاندارد را مطابق با آخرین تغییرات کتاب درسی 1404 برای شما گردآوری کردهایم. اگر به دنبال بهروزترین پاسخها برای این صفحه هستید و میخواهید بدون نیاز به اتصال به اینترنت، علاوه بر پاسخهای گام به گام، به گنجینهای از مطالب درسی دسترسی پیدا کنید، حتماً اپلیکیشن مایدرس را نصب نمایید.
📥 دانلود اپلیکیشن مایدرس
برای دسترسی آفلاین، سریع و بدون نیاز به اینترنت به گنجینهای از گامبهگامها و نمونه سوالات، اپلیکیشن را نصب کنید.
1ــ برای هر یک از موارد زیر دلیلی بیاورید.
آ) اسیدها و بازها با ثابت یونش کوچک، الکترولیت ضعیف به شمار می روند
ب) اغلب اسیدها و بازهای شناخته شده ضعیف هستند
پ) در محلول 0/1 مولار نیتریک اسید در دمای اتاق، [NO3-]=0/1 mol.L-1 است.
ت) در محلول 0/01 مولار فورمیک اسید [HCOOH]>[H+] است.
2- کاغذ pH بر اثر آغشته شدن به نمونه ای از یک محلول، به رنگ سرخ در می آید . همچنین رسانایی الکتریکی این محلول در شرایط یکسان به طور آشکاری از محلول آبی سدیم کلرید کمتر است. این محلول محتوی کدام ماده حل شونده می تواند باشد؟ توضیح دهید.
CH3OH , KOH , HCOOH , HCl , NH3
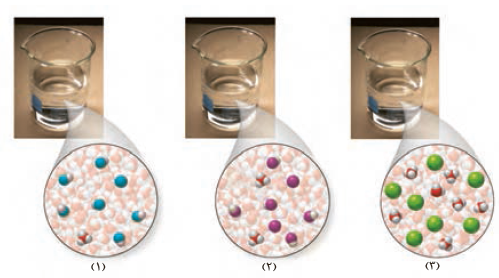
3- در دما و غلظت یکسان، هر یک از شکل های زیر به کدامیک از محلول ها تعلق دارد؟ چرا؟
آ( محلول استیک اسید ( Ka=1/8´10-5 ) .
ب( محلول هیدروبرمیک اسید ) Ka بسیار بزرگ ).
پ( محلول هیدروسیانیک اسید ( Ka=4/9´10-10 ).
4- رنگ گل ادریسی به میزان اسیدی بودن خاک بستگی دارد . این گل در خاکی که غلظت یون هیدرونیوم آن 5-10´2 مول بر لیتر است به رنگ آبی اما در خاک دیگری که غلظت یون هیدرونیوم 9-10´4 مول بر لیتر است به رنگ سرخ شکوفا می شود. pH این دو نوع خاک را حساب کنید.

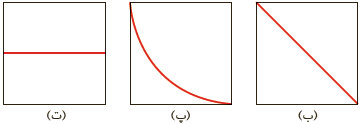
5ــ به شکل (آ) توجه کنید:
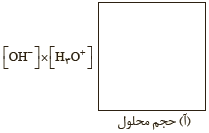
دانش آموزی برای نشان دادن ارتباط بین حاصل ضرب غلظت یون های هیدرونیوم و هیدروکسید با حجم محلول، شکل های ب تا ت را پیشنهاد داده است. کدامیک از این شکل ها ارتباط بین کمیت های داده شده را به درستی نشان می دهد؟
6- در نمونه ای از عصارۀ گوجه فرنگی، غلظت یون هیدرونیوم 106 ×4برابر غلظت یون هیدروکسید است. pHآن را حساب کنید و در جای خالی بنویسید.

7- pH یک نمونه از آب سیب برابر با 4/7 است. نسبت غلظت یون های هیدرونیوم به یون های هیدروکسید را در این نمونه حساب کنید.
8- هر یک از شکل های زیر 500 میلی لیتر از محلول آبی یک حل شونده را نشان می دهد.

آ) این حل شونده ها اسید آرنیوس هستند یا باز آرنیوس؟ چرا؟
ب) درجه یونش و pH را برای هر یک از آنها حساب کنید (هر ذره را 0/ 00 1 مول از آن گونه در نظر بگیرید).
9- HX و HY دو اسید ضعیف هستند. اگر 12 گرم از HX و 8 گرم از HY جداگانه در 1 لیتر آب حل شوند، pH این دو محلول برابر خواهد شد. با مقایسه درجه یونش آن ها مشخص کنید کدام اسید قوی تر است؟ چرا؟ (1mol HX = 150 g, 1mol HY = 50g)
10- یک کارشناس شیمی، pH نمونه هایی از 200 لیتر محلول تهیه شده ( 1 و 2 ) را اندازه گیری کرده است. حساب كنید، چه جرمی از هر ماده حل شونده به 200 لیتر آب افزوده شده است؟ از تغییر حجم چشم پوشی کنید.

11- با توجه به شكل زیر كه نمای ذره ای از یك واكنش را نشان می دهد، به پرسش ها پاسخ دهید.
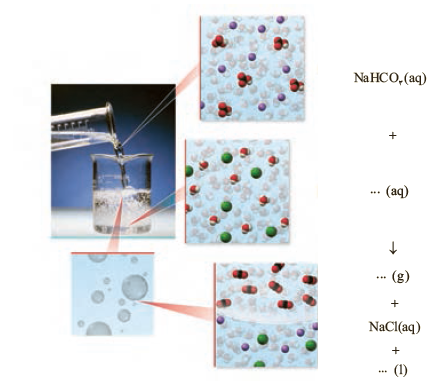
آ( هر یک از جاهای خالی را با فرمول شیمیایی مناسب پر کنید.
ب( از واكنش 100 میلی لیتر محلول هیدروكلریك اسید 0/2 مول بر لیتر با مقدار كافی از سدیم هیدروژن كربنات، چند میلی لیتر گاز كربن دی اكسید در STP تولید می شود؟
12- ثابت یونش برای محلول های BOH(aq) و B’OH(aq) در دمای اتاق به ترتیب برابر با 1/8´10-5 و 4/8´10-4 است.
آ) کدام یک باز قوی تری است؟ چرا؟
ب) pH کدام محلول کمتر است؟ چرا؟
1- آ) ثابت یونش کوچک نشان دهنده میزان یونش کم و غلظت کم یون ها در محلول است .
ب) اغلب اسیدهای شناخته شده ( آلی و معدنی ) ضعیف هستند به طوریکه مصرف خوراکی ها و داروها و همچنین استفاده از بسیاری پاک کننده های گوناگون ، این ویژگی را تأیید می کند .
پ) نیتریک اسید یک اسید قوی است . از این رو در محلول آن ، یونش به طور کامل رخ می دهد و به ازای یونش هر HNO3 در محلول، یک یون هیدرونیوم و یک یون نیترات تولید می شود . پس :
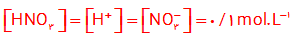
ت) فورمیک اسید یک اسید ضعیف است از این رو در محلول به طور جزئی یونیده می شود در واقع مولکول های HCOOH به طور عمده به شکل یونیده نشده در محلول وجود دارند.
رنگ سرخ کاغذ نشانه اسیدی بودن محلول است . رسانایی الکتریکی کم آن ، محلول الکترولیت ضعیف را یادآوری می کند .
2- رنگ سرخ کاغذ PH نشانه اسیدی بودن محلول است. رسانایی الکتریکی کم آن، محلول الکترولیت ضعیف را یادآوری میکند. این ویژگیهای محلول یک اسید ضعیف است که با HCOOH(aq) همخوانی دارد. HCl ، KOH و KBr الکترولیتهای قوی بوده اما CH3OH غیر الکترولیت است. NH3 با اینکه الکترولیت ضعیف است اما محلول آبی آن خاصیت بازی دارد.
3- بر اساس مقدار ثابت یونش محلول (3) با هیدروبرمیک اسید ، محلول (2) با استیک اسید ، و محلول (1) با هیدروسیانیک اسید همخوانی دارد . زیرا برای اسیدهای تک پروتون دار هرچه غلظت یون هیدرونیوم بیشتر باشد ، ثابت یونش بزرگتر است .
4-
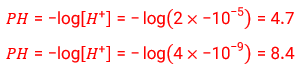
5- [OH-] همواره مقدار ثابتی است ، از این رو [H+] با توجه به اینکه در دمای ثابت برای محلول ها آبی حاصل ضرب با تغییر حجم محلول ، حاصل ضرب غلظت این یون ها ثابت می ماند در واقع نمودار (پ) برای این توصیف مناسب است.
6-
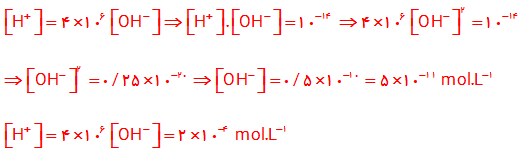
7-
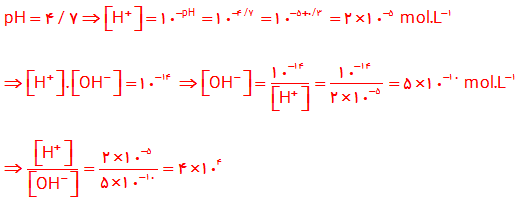
8- آ) اسید آرنیوس ، زیرا با حل شدن در آب باعث افزایش غلظت یون هیدرونیوم شده اند .
ب)
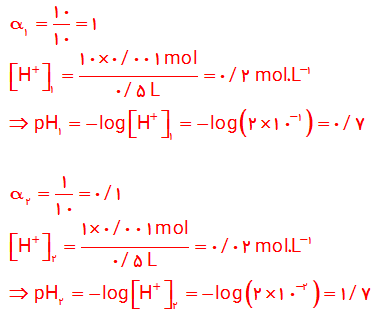
9-
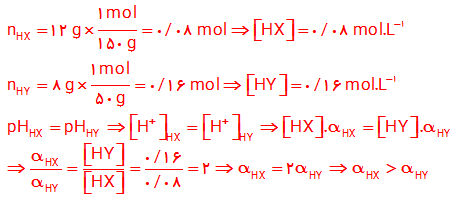
10-
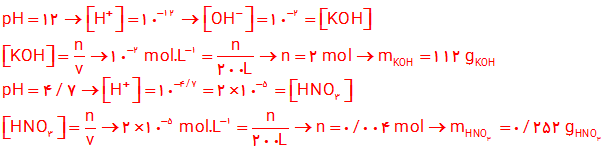
11- آ)
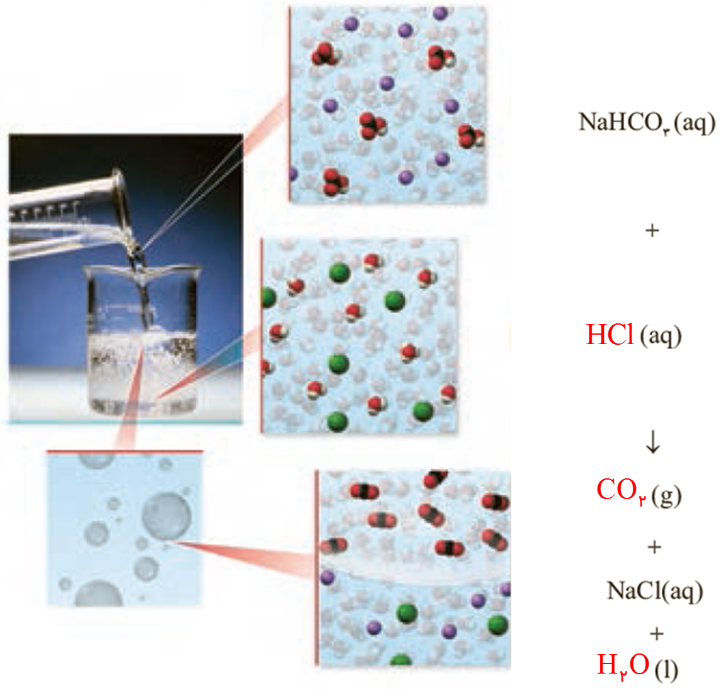
ب)

12- آ) می دانیم که هرچه ثابت یونش یک باز بیشتر باشد، باز قوی تر خواهد بود. در نتیجه محلول B’OH باز قوی تر است.
ب) محلول BOH باز ضعیفی است. در نتیجه غلظت یون هیدرونیوم آن به مراتب از محلول دیگری بیشتر است. در نتیجه pH کمتری دارد.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه چهارم تا دوازدهم- آزمون آنلاین تمامی دروس
- گام به گام تمامی دروس
- ویدئو های آموزشی تمامی دروس
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس
- فلش کارت های آماده دروس
- گنجینه ای جامع از انشاء های آماده
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه



1736019749.png)















