درسنامه کامل شیمی دهم فصل 1 کیهان زادگاه الفبای هستی
تعداد بازدید : 7.59Mخلاصه نکات شیمی دهم فصل 1 کیهان زادگاه الفبای هستی - درسنامه شب امتحان شیمی دهم فصل 1 کیهان زادگاه الفبای هستی - جزوه شب امتحان شیمی دهم نوبت اول فصل 1 کیهان زادگاه الفبای هستی
تشکیل عناصر
تشکیل عناصر
تاکنون 118 عنصر شناخته شده است که 92 عنصر در طبیعت یافت می شود. برخی دانشمندان معتقدند که آغاز کیهان با انفجار مهیب (مهبانگ) همراه بوده که انرژی زیادی آزاد کرده و سپس ذره های زیر اتمی الکترون، نوترن و پروتون و عناصر سبک هیدروژن و هلیم و ایزوتوپ های آن به وجود آمده است. ستاره ها کارخانه تولید عناصر هستند. دما و اندازه یک ستاره نوع عناصر تشکیل شده در آن را تعیین می کند. هر چه دمای ستاره بیشتر باشد امکان، تشکیل عناصر سنگین تر مانند طلا و اورانیم فراهم می شود.
انرژی واکنش های هسته ای (برای مطالعه آزاد)
در واکنش های هسته ای ، جرم به انرژی تبدیل می شود. انیشتین رابطۀ زیر را برای این تبدیل بدست آورد.
\(E = m{c^2}\)
\(c = 3 \times {10^8}\frac{m}{s}\)
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه دهم- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
ایزوتوپ ها
ایزوتوپ ها
به اتم های یک عنصر که در تعداد پروتون برابر ولی در تعداد نوترون با هم اختلاف دارند، ایزوتوپ می گویند. در هر عنصر دوکمیت A و Z که به ترتیب عدد جرمی و عدد اتمی می باشد، به صورت زیر نمایش داده می شود.
\({}_Z^AE\)= نماد همگانی
A برابر مجموع تعداد پروتون و نوترون در یک عنصر و Z تعداد پروتون است.
مثال
اتم آهن 26 الکترون، 26 پروتون، 30 نوترون دارد که به صورت: \({}_{26}^{56}Fe\)
اغلب عنصرهای طبیعی، مخلوطی از چند ایزوتوپ هستند. برای مثال یک نمونه از فلز منیزیم مخلوطی از سه ایزوتوپ می باشد.
جزوات جامع پایه دهم
جزوه جامع شیمی دهم فصل 1 کیهان زادگاه الفبای هستی
جزوه جامع شیمی دهم فصل 2 ردِّ پای گازها در زندگی
جزوه جامع شیمی دهم فصل 3 آب، آهنگ زندگی
کاربرد ایزوتوپ های پرتوزا
کاربرد ایزوتوپ های پرتوزا
برخی از ایزوتوپ ها خاصیت پرتوزایی دارند. از این خاصیت می توان سن اشیاء قدیمی و عتیقه را تخمین زد. همچنین از این ایزوتوپ ها در پزشکی هسته ای استفاده می شود. یکی از آنها تکنسیم است که به طور مصنوعی ساخته شده و در تصویر برداری غده تیروئید بکار می رود. یون یدید مشابه یون تکنسیم است و جذب غده می شود و قابل تصویر برداری است.
یک کاربرد دیگر این مواد پرتوزا در تشخیص سلول های سرطانی می باشد. با استفاده از گلوکز نشان دار می توان تومورهای سرطان زا را تشخیص داد. سلول های سرطانی فعالیت شیمیایی زیاد و سوخت و ساز بالایی دارند. در نتیجه قند بیشتری جذب کرده و پرتوزایی زیادی نشان می دهند که آنها را نشان می دهد که آشکار ساز آنها را نشان می دهد. کاربرد دیگر مواد پرتوزا در تولید برق در نیروگاه است که از عنصر اورانیوم پرتوزا استفاده می شود. مقدار فراوانی این ایزوتوپ کمتر از 7/0 درصد است که با غنی سازی ایزوتوپی جداسازی می گردد. پسماند راکتور های اتمی پرتوزا و خطرناک می باشد و هنوز قابل بازگردانی نیست و باید انبار شود.
گاز رادون: یکی از فراوان ترین مواد پرتوزا در اطراف ما است که بی رنگ، بی بو، بی مزه و سنگین است. در لایه های زیر زمین تولید می شود و به دلیل دما و فشار سطح زمین به بالا نفوذ می کند، در پزشکی کاربرد دارد.
هلیم: گاز بی بو و بی رنگ که در بالن هواشناسی، تفریحی و تبلیغاتی، در جوشکاری و کپسول غواصی، خنک کردن قطعات الکترونیکی کاربرد دارد. این گاز به علت جرم مولی بیشترش نسبت به هیدروژن، دارای رسانش و ظرفیت گرمایی بالایی است. در جهان هستی فراوان ترین عنصر بعد از هیدروژن است. این گاز از واکنش هسته ای تولید می شود و به میدان های گازی وارد می شود. 7 درصد گاز طبیعی را هلیم تشکیل می دهد و از تقطیر جز به جز گاز طبیعی جدا می شود.
طبقه بندی عناصر
طبقه بندی عناصر
گفتیم تاکنون 118 عنصر شناخته شده که در جدول زیر بر اساس افزایش عدد اتمی و خواص مشابه عناصر در یک ستون (گروه) مرتب شده اند. در این جدول به ستون عمودی گروه و ردیف افقی دوره (تناوب) می گویند. عناصر در یک گروه خواص شیمیایی مشابهی دارند.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه دهم- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
محاسبه جرم اتمی
محاسبه جرم اتمی
برای محاسبه جرم اتمی از مقیاس نسبی استفاده می کنیم. مقیاس یا واحد اندازه گیری جرم \(\frac{1}{{12}}\)اتم کربن \({}_6^{12}C\) می باشد که به آن amu یا یکای جرم اتمی گویند. با تعریف جرم اتمی، دانشمندان جرم اتمی همه عناصر را نسبت به آن اندازه گیری کردند.
جرم اتمی میانگین
با توجه به اینکه در نمونه طبیعی هر عنصر ایزوتوپ های با جرم متفاوت وجود دارد، باید جرم اتمی میانگین با استفاده از فرمول زیر جرم دقیق اتم شود.محاسبه ها توسط طیف سنج جرمی اندازه شود.
جرم اتمی میانگین = \(\frac{{{m_1}{x_1} + {m_2}{x_2} + ...}}{{{x_1} + {x_2} + ...}}\)
M1 جرم اتمی ایزوتوپ 1 و M2 جرم اتمی ایزوتوپ 2
X1 درصد (تعداد) ایزوتوپ 1 و X2 درصد (تعداد) ایزوتوپ 2
جزوات جامع پایه دهم
جزوه جامع شیمی دهم فصل 1 کیهان زادگاه الفبای هستی
جزوه جامع شیمی دهم فصل 2 ردِّ پای گازها در زندگی
جزوه جامع شیمی دهم فصل 3 آب، آهنگ زندگی
شمارش اتم ها و عدد آوودگادرو
شمارش اتم ها و عدد آوودگادرو
در شیمی برای تعیین تعداد اتم ها یا مولکول ها، تعداد آن را در یک مول ذره محاسبه می کنند. در هر مول از یک ماده تعداد ذره برابر عدد \(6/022 \times {10^{23}}\) می باشد.
با استفاده از هم ارزی میان كمیت ها می توان آنها را به یكدیگر تبدیل كرد به طوری كه برای هر هم ارزی میتوان دو عامل (كسر) تبدیل نوشت. در این عامل ها، صورت و مخرج هر یک شامل عددی همراه با یكاست؛ برای نمونه از هم ارزی 100cm = 1mمی توان این دو عامل تبدیل را نوشت:
\(\frac{{1m}}{{100cm}}\) و \(\frac{{100cm}}{{1m}}\)
مثال
به عنوان مثال برای 1molC = 12/01gCمی توان دو عامل تبدیل به صورت زیر نوشت:
\(\frac{{1molC}}{{12/01gC}}\) و \(\frac{{12/01gC}}{{1molC}}\)
بنابراین برای تبدیل جرم 0/6 گرم كربن به مول های آن می توان نوشت:
\(?molC = 0/6gC \times \frac{{1molC}}{{12/01gC}} = 0/4molC\)
نور کلید شناخت جهان
نور کلید شناخت جهان
نور شکلی از انرژی است که به صورت موج منتشر می شود. با استفاده از طیف سنج می توان نور را تجزیه کرد و رنگ های مختلفی را ایجاد کرد که شامل بی نهایت موج است. چشم ما می تواند گستره رنگ های قرمز تا بنفش را ببیند که به آن طیف مرئی می گویند. طول موج نور با انرژی آن رابطه عکس دارد برای نمونه انرژی نور آبی از قرمز بیشتر است. طول موج را با \(\lambda \) نماش می دهند. از بین تمام امواج الکترو مغناطیس خورشید فقط امواج مرئی قابل دیدن است و بقیه قابل دیدن نیستند.
نشر نور و طیف نشری خطی
تجربه نشان می دهد که فلز ها و نمک فلز ها رنگ شعله را تغیر می دهند. برای مثال نمک های سدیم رنگ زرد متمایل به نارنجی، فلز مس و نمک های آن رنگ سبز، لیتیم قرمز لاکی و کلسیم قرمز آجری می باشد. وقتی یک ترکیب شیمیایی در شعله قرار گیرد طول موج های نوری که تولید می شود، طیف نشری خطی نامیده می شود. طیف نشری را به صورت خطوط عمودی روی یک نوار افقی با طول موج نمایش می دهند.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه دهم- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
کشف ساختار اتم
کشف ساختار اتم
هر خط یا نوار رنگی در طیف نشری خطی عنصر یک طول موج و انرژی معینی دارد که مطالعه تعداد و جایگاه این خط ها، اطلاعاتی را از ساختار الکترونی اتم در اختیار ما می گذارد. نیلز بور با مطالعه طیف نشری خطی اتم هیدروژن توانست یک مدل برای ساختار اتم هیدروژن ارائه کند. او هر خط طیفی را به یک انتقال الکترون بین ترازهای انرژی نسبت داد. انتقال الکترون از حالت پر انرژی تر به حالت کم انرژی تر نور منتشر می کند. هر اتم با آرایش الکترونی ویژۀ خود دارای انرژی معینی بوده و از پایداری ویژهای برخوردار است که به آن حالت پایه می گویند.
حالت برانگیخته یعنی با گرما یا تابش نور، می توان آرایش الکترونی را برای لحظه ای تغییر داد که به این شرایط اتم حالت برانگیخته می گویند.
جزوات جامع پایه دهم
جزوه جامع شیمی دهم فصل 1 کیهان زادگاه الفبای هستی
جزوه جامع شیمی دهم فصل 2 ردِّ پای گازها در زندگی
جزوه جامع شیمی دهم فصل 3 آب، آهنگ زندگی
مدل کوانتومی اتم
مدل کوانتومی اتم
برای توجیه طیف نشری عنصرها و چگونگی نشر آنها، ساختار لایه ای در نظر می گیرند. این مدل برای اتم برای اتم اطراف هسته تعدادی لایه در نظر می گیرد. شماره هر لایه را با n (عدد کوانتومی اصلی) نشان می دهند. در این مدل هسته در فضای کوچک و مرکز آن قرار دارد و الکترون در فضای بزرگ و در لایه ها توزیع می شود. الکترون ها در تمام نقاط لایه ها حضور دارند ولی احتمال حضور آنها در یک محدوده بیشتر است. در هر لایه الکترون انرژی معینی دارد و با فاصله از هسته زیاد می شود. هر چه لایه ها به آخر نزدیک می شود انرژی آنها به هم نزدیک تر می شود. با گرما یا تابش در حالت گازی، الکترون های اتم با جذب انرژی از لایه ای به لایه دیگر جابه جا می شوند و بر اثر بازگشت الکترون به لایه قبلی، تابش گسیل می شود همان طیف نشری خطی عنصر است. چون هر اتم لایه های مخصوص به خود دارد، در نتیجه طیف نشری خطی نیز ویژه همان اتم است.
طیف نشری اتم هیدروژن در ناحیه مریی، این قسمت از طیف هیدروژن در اثر بازگشت الکترون به لایه 2ا تفاق می افتد. از انتقال الکترون از لایه 6، 5، 4 و 3 به لایه 2، چهار خط طیفی با طول موج های 410، 434، 486 و 656 نانومتر ایجاد می شود. انرژی الکترون ها کوانتومی است. به این مفهوم که انرژی الکترون مقادیر معین و مشخص است و مانند پله های نردبان بین پله ها توقف ندارد، یعنی الکترون هنگام جابه جایی بین لایه ها محدودیت های مشابهی مانند پله های نردبان دارد. به این مدل، مدل کوانتومی اتم گویند.
آرایش اتمی الکترون
آرایش اتمی الکترون
اتم در اطراف هسته دارای چند لایه می باشد که تا لایه هفتم آن در عناصر جدول تناوبی پر می شود. تعداد الکترون در هر لایه مقدار مشخصی می باشد و هر لایه از چند زیر لایه تشکیل می شود. زیر لایه موارد زیر است.
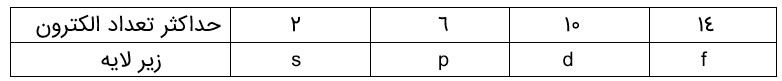
تعداد الکترون هر لایه با توجه به عدد کوانتومی n (شماره لایه(برابر \(2{n^2}\) می باشد. پر شدن الکترون در اتم طبق اصل آفبا (واژه آلمانی به معنی ساختن یا افزایش گام به گام) صورت می گیرد.
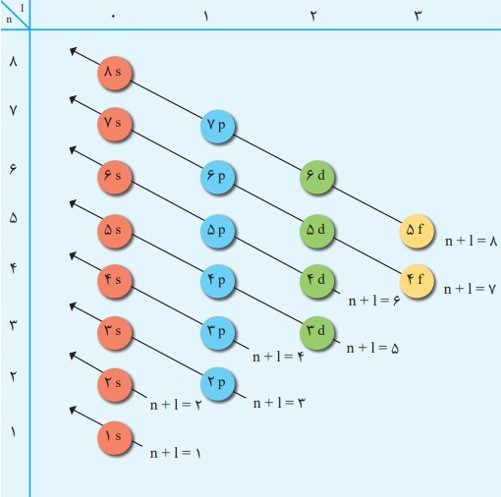
1s / 2s 2p / 3s 3p / 4s 3d 4p / 5s 4d 5p / 6s 4f 5d 6p / 7s 5f 6d 7p
انرژی زیرلایه ها به n و n+I وابسته است به طوری که اگر n+I برای دو یا چند زیر لایه یکسان باشد، زیر لایه با n بزرگتر، انرژی بیشتری دارد.
داده های طیف سنجی نشان می دهد كه آرایش الكترونی برخی اتم ها از قاعدۀ آفبا پیروی نمی كند؛ برای نمونه هر یک از اتم های كروم و مس در بیرونی ترین زیر لایۀ خود تنها یک الكترون دارد.
در رسم آرایش الکترونی به روش فشرده یا خلاصه، از یک گاز نجیب کوچک تر از عدد اتمی عنصر برای رسم آرایش الکترونی آن استفاده می شود، یعنی گاز نجیب کوچک تر را داخل کروشه نوشته و ادامه آرایش الکترونی بعد از گاز نجیب نوشته می شود. مثال:
\({}_{11}Na:[{}_{10}Ne],3{s^1}\)
اهمیت آرایش الکترونی فشرده به دلیل نمایش آرایش الكترون ها در بیرونی ترین لایه به نام لایۀ ظرفیت اتم است. لایۀ ظرفیت یک اتم، لایه ای است که الکترون های آن، رفتار شیمیایی اتم را تعیین می کند. به الکترون های این لایه، الکترون های ظرفیت اتم می گویند.
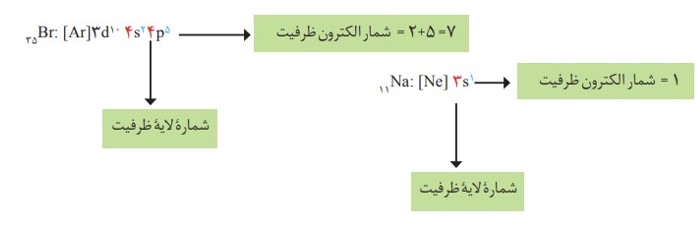
در عنصرهای دستۀ d از دورۀ چهارم، الکترون های ظرفیت شامل الکترون ها در زیرلایه های4s و d3 است.
دسته بندی عناصر
عناصر را براساس زیر لایه در حال پر شدن آنها به چهار دسته تقسیم می کنیم:
- عنصرهای دسته s که در آنها زیر لایه sدر حال پر شدن است و شامل عنصرهای گروه 1 و 2 می شود. مانند: \({}_{11}Na\) و \({}_{12}Mg\)
- عنصرهای دسته p که شامل گروه های 13 تا 18 می باشد.
- عنصرهای دسته d که شامل گروه های 3 تا 12 می باشد که عناصر واسطه نام دارد.
- عنصرهای دسته f که شامل دو ردیف 14 عنصری می باشد.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه دهم- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
ساختار اتم و رفتار آن
ساختار اتم و رفتار آن
گازهای نجیب در طبیعت به شكل تک اتمی یافت می شوند. این واقعیت بیانگر این است كه این گازها واكنش ناپذیر بوده یا واكنش پذیری بسیار كمی دارند، از این رو پایدارند.
\({}_2He:1{s^2}\)
\({}_{10}Ne:[He],2{s^2}2{p^6}\)
در لایۀ ظرفیت این اتم ها، هشت الكترون وجود دارد (به جز هلیم كه در تنها لایۀ الكترونی خود، دو الكترون دارد)؛ با این توصیف می توان نتیجه گرفت كه بین پایداری و آرایش الكترونی لایۀ ظرفیت اتم ها باید رابطه ای باشد به طوری كه اگر لایۀ ظرفیت اتمی، همانند آرایش الکترونی یک گاز نجیب بوده یا هشت تایی باشد، آن اتم واكنش پذیری چندانی ندارد؛ به دیگر سخن اگر لایۀ ظرفیت اتمی چنین نباشد، آن اتم واكنش پذیر است. لوویس برای توضیح و پیش بینی رفتار اتم ها، آرایشی به نام آرایش الكترون ــ نقطه ای ارائه کرد كه در آن الكترون های ظرفیت هر اتم، پیرامون نماد شیمیایی آن با نقطه نمایش داده می شود؛ برای نمونه، آرایش الكترون ــ نقطه ای سدیم به صورت Na. است. برای رسم آرایش الکترون ــ نقطه ای هر اتم، می توان نقطه گذاری را از یک سمت مانند سمت راست نماد شیمیایی عنصر آغاز کرد و نقطه های بعدی را در زیر، سمت چپ و بالای آن قرار داد. الکترون پنجم و پس از آن را باید طوری پیرامون نماد شیمیایی عنصر قرار داد كه هر یک به صورت جفت نقطه درآید؛
برای مثال آرایش الكترون ــ نقطه ای اتم های كربن، فسفر و آرگون به صورت زیر است:
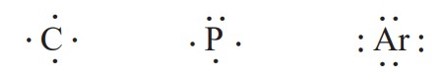
رفتار شیمیایی هر اتم به شمار الكترون های ظرفیت آن بستگی دارد به طوری كه می توان دستیابی به آرایش گاز نجیب را مبنای رفتار آنها دانست. در واقع اتم ها می توانند با دادن الكترون، گرفتن الكترون و نیز به اشتراک گذاشتن آن به آرایش یك گاز نجیب برسند یا هشت تایی شوند تا پایدارتر گردند. هرگاه اتم های سدیم و كلر كنار یكدیگر قرار گیرند، اتم سدیم با از دست دادن یک الكترون به یون سدیم و اتم كلر با گرفتن یک الكترون به یون كلرید تبدیل شده و در این واكنش سدیم كلرید (نمک خوراكی) تولید می شود.
از دسـت دادن، گـرفـتـن یـا بـه اشتراک گذاشتن الكترون نشانه ای از رفتار شیمیایی اتم است.
جزوات جامع پایه دهم
جزوه جامع شیمی دهم فصل 1 کیهان زادگاه الفبای هستی
جزوه جامع شیمی دهم فصل 2 ردِّ پای گازها در زندگی
جزوه جامع شیمی دهم فصل 3 آب، آهنگ زندگی
تبدیل اتم ها به یون ها
تبدیل اتم ها به یون ها
اتم اكسیژن برای رسیدن به آرایش گاز نجیب پس از خود باید دو الکترون بگیرد درحالی كه اتم كلسیم باید دو الكترون ظرفیت خود را از دست بدهد تا به آرایش پایدار گاز نجیب پیش از خود برسد؛ به دیگر سخن هرگاه اتم های این دو عنصر در شرایط مناسب، كنار هم قرار گیرند، با هم واكنش می دهند به طوری كه با داد و ستد الكترون به یون های \({O^{2 - }}\) و \(C{a^{2 + }}\) تبدیل می شوند. میان یون های تولید شده به دلیل وجود بارهای الکتریکی ناهمنام، نیروی جاذبۀ بسیار قوی برقرار می شود؛ نیروی جاذبه ای كه پیوند یونی نامیده می شود. تركیب حاصل از این واکنش، كلسیم اكسید نام دارد که آن را با فرمول شیمیایی CaO نشان می دهند. این فرمول شیمیایی نشان می دهد که كلسیم و اكسیژن دو عنصر سازندۀ این ترکیب اند و نسبت یون های سازندۀ آن 1 به 1 است. ترکیب هایی از این دست که ذره های سازندۀ آنها یون است، تركیب یونی نام دارند.
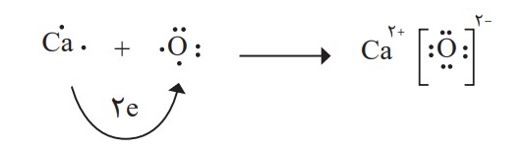
1 یون تک اتمی، كاتیون یا آنیونی است كه تنها از یک اتم تشكیل شده است؛ برای نمونه هریک از یون های \(N{a^ + }\) و \(C{l^ - }\) ، تک اتمی هستند.
2 هر تركیب یونی كه تنها از دو عنصر ساخته شده، ترکیب یونی دوتایی نامیده مـی شـود. ایـن ترکیب ها می توانند از واکنش فلزها با نافلزها پدید آیند.
3 فرمول شیمیایی کلسیم کلرید نشان می دهد که نسبت کاتیون به آنیون سازندۀ آن، 1 به 2 است.
تبدیل اتم ها به مولکول ها
تبدیل اتم ها به مولکول ها
بسیاری از تركیب های شیمیایی در ساختار خود هیچ یونی ندارند و ذره های سازندۀ آن ها مولكول ها هستند .بنابر این به آرایش الکترون _ نقطه ای اتم کلر توجه کنید.
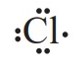
گاز كلر که خاصیت رنگ بری و گندزدایی دارد از مولكول های دو اتمی (\(C{l_2}\) ) تشكیل شده است. با توجه به آرایش الكترون ــ نقطه ای اتم كلر می توان تشكیل این مولكول را به صورت زیر نشان داد:
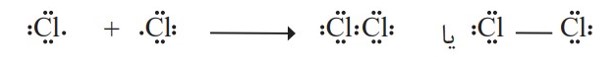
با این توصیف هر اتم كلر، تک الكترون خود را با دیگری به اشتراك می گذارد به طوری كه دو الكترون موجود بین دو اتم در آرایش الكترون ــ نقطه ای به هر دوی آنها تعلق دارد. در این وضعیت هر یک از اتم ها به آرایش هشت تایی رسیده است.
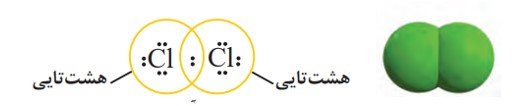
جفت الكترون اشتراكی میان دو اتم كلر در مولكول \(C{l_2}\) نشان دهندۀ یک پیوند اشتراکی (كووالانسی) است؛ پیوندی كه سبب اتصال دو اتم به یكدیگر در مولكول شده است؛ به دیگر سخن اتم نافلزها در شرایط مناسب با تشكیل پیوندهای اشتراکی می توانند مولكول های دو یا چند اتمی را بسازند.
مواد شیمیایی خالصی که در ساختـار خـود مـولـکـول دارنـد، مواد مـولکولـی نامیده می شونـد.
چگونگی تشکیل و نمایش مولکول های اکسیژن و آب
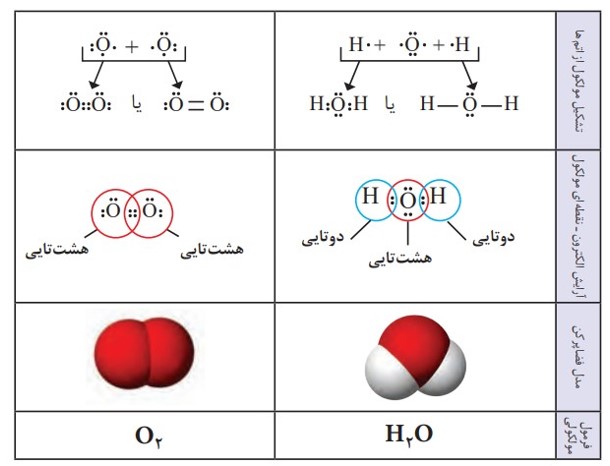
به فرمول شیمیایی که افزون بر نوع عنصرهای سازنده، شمار اتم های هر عنصر را در مولکول نشان می دهد، فرمول مولکولی می گویند.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه دهم- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم



1736019749.png)















