درسنامه کامل شیمی دهم فصل 3 آب، آهنگ زندگی
تعداد بازدید : 7.59Mخلاصه نکات شیمی دهم فصل 3 آب، آهنگ زندگی - درسنامه شب امتحان شیمی دهم فصل 3 آب، آهنگ زندگی - جزوه شب امتحان شیمی دهم نوبت اول فصل 3 آب، آهنگ زندگی
کره زمین
کره زمین
کره ی زمین با اتمسفر یا جوی سرشار از اکسیژن و سطحی پوشیده از آب فراوان، همانند سفینه ای بسیار بزرگ و مجهز که آب و آذوقه ما را تامین می کند.
کره ی زمین در منطومه ی خورشیدی امن ترین جا برای زندگی انسان ها و دیگر جانداران و پهناورترین زیستگاه برای آبزیان است.
زمین در فضا به رنگ آبی دیده می شود زیرا نزدیک به 75% سطح آن را آب پوشیده شده است.
جرم زمین در حدود \(6 \times {10^{21}}\) تن است و جرم کل آب روی کره ی زمین در حدود \(1/5 \times {10^{18}}\) تن برآورد شده است.
بخش عمده آب موجود در کره ی زمین در اقیانوس ها و دریاها وجود دارد به طوری که اگر کره ی زمین را مسطح در نظر بگیریم آب همه ی سطح آن را تا ارتفاع 2 متر می پوشاند.
آب اقیانوس ها و دریاها مخلوطی همگن است که اغلب مزه ی شور دارند زیرا مقدار قابل توجهی از انواع نمک ها در آن حل شده است. و حدود\(1/5 \times {10^{16}}\) تن نمک در آب اقیانوس ها و دریاها وجود دارد.
جرم کل مواد حل شده در آب های کره ی زمین تقریباً ثابت است یعنی زمین از نظر شیمیایی پویا است.
کره ی زمین را می توان یک سامانه بزرگ در نظر گرفت که شامل چهار بخش هواکره، سنگ کره، آب کره و زیست کره می باشد.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه دهم- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
پویا بودن زمین از دیدگاه شیمیایی
پویا بودن زمین از دیدگاه شیمیایی
زمین یک سامانه ای است که شامل چهار بخش هواکره، آب کره، سنگ کره و زیست کره است.
هواکره از مولکول های کوچک نیتروژن، اکسیژن و ... و آب کره از مولکول های کوچک آب و یون ها و سنگ کره از مواد جامد، ماسه، نمک ها و ... تشکیل شده است و زیست کره شامل جانداران روی کره ی زمین است که در واکنش های آن ها درشت مولکول ها نقش اساسی دارند.
بخش های کره ی زمین با یکدیگر بر هم کنش های فیزیکی و شیمیایی دارند و زمین از دیدگاه شیمیایی پویا است.
سالانه حجم زیادی از آب دریاها و اقیانوس ها بخار می شود و وارد هواکره می شوند و به صورت باران و برف در آب کره، سنگ کره و زیست کره می بارد که این بر هم کنش آب کره با سه بخش دیگر است.
جانوران آبزی سالانه میلیاردها تن گاز کربن دی اکسید را وارد هواکره می کنند و مقدار زیادی از گاز اکسیژن محلول در آب را مصرف می کنند و این بر هم کنش آب کره و زیست کره می باشد.
فعالیت های آتش فشان ها باعث می شوند گازهای گوناگون و مواد شیمیایی جامد به صورت گرد و غبار وارد هواکره می شود و این بر هم کنش سنگ کره با هواکره می باشد.
بدن جانوران و گیاهان بر اثر واکنش های شیمیایی تجزیه شده و به صورت مولکول های کوچک تری وارد آب کره و سنگ کره می شوند و هم چنین جانداران سالانه مقدار بسیار زیادی از ترکیب های کربن دار را وارد بخش های گوناگون کره ی زمین می کنند و این بر هم کنش زیست کره با آب کره، هواکره و سنگ کره می باشد.
جزوات جامع پایه دهم
جزوه جامع شیمی دهم فصل 1 کیهان زادگاه الفبای هستی
جزوه جامع شیمی دهم فصل 2 ردِّ پای گازها در زندگی
جزوه جامع شیمی دهم فصل 3 آب، آهنگ زندگی
آب آهنگ زندگی
آب آهنگ زندگی
97/2% از آب های کره زمین در اقیانوس ها، 2/15% از آب ها در کوه های یخ و باقی آب های کره زمین را آب های زیر زمینی تشکیل می دهند.
بیشتر آب های روی زمین شور است و نمی توان از آنها در كشاورزی، مصارف خانگی و صنعتی استفاده كرد؛ از این رو تهیۀ آب شیرین و آشامیدنی، همچنین آب قابل استفاده در كشاورزی، صنعت و دیگر حوزه ها یكی از چالش های اساسی در سطح جهان است. از سوی دیگر اقیانوس ها، دریاها، دریاچه ها و ... منابع ارزشمندی برای تهیه و استخراج مواد شیمیایی گوناگون، تولید فراورده های پروتئینی، مواد و وسایل تزیینی، تهیۀ داروهای گوناگون و ... هستند.
آب باران در هوای پاک تقریبا خالص است، زیرا هنگام تشكیل برف و باران، تقریبا همۀ مواد حل شده در آب از آن جدا می شود. این فرایند، الگویی برای تهیۀ آب خالص است. فرایندی كه تقطیر و فراوردۀ آن آب مقطر نام دارد.
همراهان ناپیدای آب
همراهان ناپیدای آب
دریاها مخلوطی همگن از انواع یون ها و مولكول ها در آب هستند. نوع و مقدار مواد حل شده در دریاها با یكدیگر تفاوت دارند، زیرا آب هایی كه به دریاها می ریزند در مسیر خود از زمین هایی گذر می كنند كه مواد شیمیایی گوناگون دارند. اغلب چشمه ها، قنات ها و رودخانه ها، آبی زلال و شفاف دارند كه شیرین، گوارا و آشامیدنی است.
آب آشامیدنی، مخلوطی زلال و همگن بوده که حاوی مقدار كمی از یون های گوناگون است. برخی از این یون ها به طور طبیعی در آب حل شده و برخی دیگر در مراكز تأمنی آب آشامیدنی سالم به آن افزوده می شود. برای نمونه به آب آشامیدنی، مقدار بسیار کم و مناسب یون فلوئورید می افزایند زیرا وجود این یون سبب حفظ سلامت دندان ها می شود.
1 در برخی از آب های آشامیدنی مقدار یون های حل شده به قدری زیاد است كه مزۀ آب را تغییر می دهد.
2 تفاوت آب آشامیدنی و دیگر آب ها در نوع و مقدار حل شونده های آنها است.
برخی از یونهای موجود در آب آشامیدنی، مانند \({F^ - },N{a^ + },C{l^ - },C{a^{2 + }}\) تک اتمی هستند، درحالی كه برخی دیگر مانند یون نیترات (\(No_3^ - \) ) و یون سولفات (\(SO_4^{2 - }\) ) از چند اتم تشكیل شده اند. این یون ها را یون های چند اتمی می نامند. پتاسیم سولفات، تركیبی یونی است كه هر واحد آن شامل دو یون تك اتمی پتاسیم و یك یون چند امتی سولفات است.
یونی که از اتصال دو یا چند اتم تشکیل شده است، یون چند اتمی نام دارد.
برای نوشتن فرمول شیمیایی این تركیب ها، نخست نماد كاتیون را سمت چپ و فرمول شیمیایی آنیون را در سمت راست می نویسند. با توجه به اینكه یك تركیب یونی خنثی است، بر این اساس شمار كاتیون ها و آنیون ها را مشخص می كنند و به صورت زیروند در سمت راست هر یون قرار می دهند.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه دهم- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
محلول و حل شونده ها
محلول و حل شونده ها
محلول مخلوطی همگن از دو یا چند ماده بوده که حالت فیزیکی و ترکیب شیمیایی در سرتاسر آن یکسان و یکنواخت است. محلول ها كاربردهای فراوانی در زندگی ما دارند برخی محلول ها مانند سرم فیزیولوژی رقیق و برخی مانند گلاب دو آتشه غلیظ هستند. هنگامی كه گفته می شود محلولی غلیظ است یعنی مقدار (حل شونده ها) در آن زیاد است.
مقدار نمك های حل شده در آب دریاهای گوناگون نیز با هم تفاوت دارد. برای نمونه در هر 100 گرم از آب دریای مرده (بحرالمیت)، حدود 27 گرم حل شونده (انواع نمک ها) وجود دارد؛ از این رو آب این دریا محلول غلیظی است كه انسان می تواند به راحتی روی آن شناور بماند. دریاچۀ ارومیه نیز یكی از دریاچه های شور دنیاست كه مقدار نمك های حل شده در آن بسیار زیاد است. محلول آبی این دریاچه نیز بسیار غلیظ است؛ از این رو دریاچۀ ارومیه منبع غنی از مواد شیمیایی گوناگون به شمار می آید.
هر محلول از دو جزء، حلال و حل شونده تشكیل شده است. درواقع، حلال جزئی از محلول است که حل شونده را در خود حل می کند و شمار مول های آن بیشتر است. خواص محلول ها به خواص حلال، حل شونده و مقدار هر یك از آنها بستگی دارد. بنابراین دانستن اینكه چه مقدار حل شونده در یك محلول وجود دارد، می تواند به درك خواص، رفتار و كاربرد آن محلول كمك کند. شیمی دان ها غلظت یك محلول را مقدار حل شونده در مقدار معینی از حلال یا محلول تعریف می كنند. آنها در آزمایشگاه با محلول های گوناگونی سروكار دارند كه مقدار حل شونده در آنها در گستره ای از مقدار بسیار كم تا مقدار بسیار زیاد متغیر است. از این رو غلظت محلول ها را به روش های گوناگون بیان می كنند.
جزوات جامع پایه دهم
جزوه جامع شیمی دهم فصل 1 کیهان زادگاه الفبای هستی
جزوه جامع شیمی دهم فصل 2 ردِّ پای گازها در زندگی
جزوه جامع شیمی دهم فصل 3 آب، آهنگ زندگی
قسمت در میلیون
قسمت در میلیون
هرگاه 0/5 گرم مس (II) سولفات را در 99/5 گرم آب حل كنید، محلولی زیبا به رنگ آبی به دست می آید. حال اگر این محلول را با افزودن آب، چندین مرتبه رقیق تر کنیم، محلولی بسیار كم رنگ پدید می آید كه گویی رنگ ندارد. ظاهر بی رنگ آن نشان می دهد كه محلول بسیار رقیق بوده و مقدار حل شونده در آن بسیار كم است برای بیان ساده تر غلظت محلول های بسیار رقیق مانند غلظت کاتیون ها و آنیون ها در آب معدنی، آب آشامیدنی، آب دریا، بدن جانداران، بافت های گیاهی و مقدار آلاینده های هوا از كمیتی به نام قسمت در میلیون (ppm) استفاده می شود. این كمیت نشان می دهد كه در یك میلیون گرم از محلول، چند گرم حل شونده وجود دارد.
ppm از رابطۀ زیر به دست می آید:
\(ppm = \frac{{m(r)}}{{m(s)}} \times {10^6}\)
m(r) به معنای جرم حل شونده است.
m(s) به معنای جرم محلول است.
مثال
در یك نمونه آب آشامیدنی به جرم 2٠٠ گرم، 0/05 میلی گرم یون فلوئورید وجود دارد غلظت یون \(F{e^ - }\) در این نمونه چند ppm است؟
ppm = شونده حل جرممحلول / جرم × 106 = \(\frac{{5 \times {{10}^{ - 5}}g}}{{200g}} \times {10^6} = 0/25ppm\)
1 توجه کنید در این رابطه، یكای جرم در صورت و مخرج كسر باید یكسان باشد.
2 درصد جرمی را با نماد %W/W نشان می دهند كه هم ارز با شمار قسمت های حل شونده در 100 قسمت از محلول است.
مواد شیمیایی موجود در آب دریا را می توان به روش های فیزیكی یا شیمیایی از آن جدا كرد. برای نمونه سالانه میلیون ها تن سدیم كلرید با روش تبلور از آب دریا جداسازی و استخراج می شود.
جداسازی حل شونده از محلول به شکل بلورهای جامد را تبلور می نامند.
فلز منیزیم مادۀ ارزشمند دیگری است كه در تهیۀ آلیاژها، شربت معده و ... كاربرد دارد. یكی از منابع تهیۀ این فلز آب دریاست. منیزیم در آب دریا به شکل (aq)\(M{g^{2 + }}\) وجود دارد. برای استخراج و جداسازی آن، در مرحلۀ نخست منیزیم را به صورت ماده جامد و نامحلول\(Mg{(OH)_2}\) رسوب می دهند، سپس آن را به منیزیم كلرید تبدیل می كنند. در پایان با استفاده از جریان برق، منیزیم كلرید مذاب را به عنصرهای سازندۀ آن تجزیه می كنند.
\(MgCl{}_2(l) \to Mg(l) + C{l_2}(g)\)
غلظت مولی
غلظت مولی
غلظت بسیاری از محلول ها در صنعت، پزشکی، داروسازی، کشاورزی و زندگی روزانه با درصد جرمی بیان می شود، برای نمونه سرکۀ خوراکی با خاصیت اسیدی ملایم که به عنوان چاشنی در غذاها مصرف می شود، محلول ٥ درصد جرمی استیک اسید در آب است. همچنین محلول غلیظ نیتریک اسید در صنعت با غلظت ٧٠ درصد جرمی تولید و بسته به کاربرد آن، به محلول های رقیق تر تبدیل می شود. با این توصیف نباید چنین تصور شود که تهیۀ محلول ها به حالت مایع، با درصد جرمی معنی کار آسانی است. تجربه نشان می دهد که اندازه گیری حجم یک مایع به ویژه در آزمایشگاه، آسان تر از جرم آن است از سوی دیگر شیمی دان ها مقدار ماده را برحسب مول بیان می کنند در واقع مبنای محاسبه های کمی در شیمی، مول است. اینک چنین به نظر می رسد بیان غلظتی از محلول پرکاربرد تر خواهد بود که با مول های مادۀ حل شونده و حجم محلول ارتباط داشته باشد. چنین غلظتی را غلظت مولی (مولار) می نامند.
1 هنگام بیماری، توازن غلظت برخی گونه ها در خون به هم می خورد. از این رو انجام آزمایش های پزشکی و تعیین غلظت گونه های موجود در خون و دیگر محلول های بدن از ضروری ترین کارها در مراکز درمانی برای رسیدگی به یک بیمار است.
2 محلول مولار سدیم هیدروکسید نشان می دهد که در هر لیتر از این محلول، 1mol سدیم هیدروکسید حل شده است. از این رو در 0/1 لیتر از این محلول، 0/1 مول و در 10 لیتر از آن، 10 مول سدیم هیدروکسید حل شده وجود دارد.
مثال
برای تهیۀ 250 mL محلول پتاسیم یدید 0/2 مول بر لیتر )مولار( به چند مول حل شونده نیاز است؟
روش اول:
غلظت مولی = شونده حل های مولمحلول / حجم = \(\frac{{n(mol)}}{{V(L)}}\)
\(0/2mol{L^{^{ - 1}}} = \frac{{n(KI)}}{{0/25L}} \to n = 0/2mol{L^{ - 1}} \times 0/25L = 0/05mol\)
روش دوم:
محلول 0/2 مولار پتاسیم یدید نشان می دهد که در هر لیتر از محلول آن 0/2 مول KI حل شده است که از آن می توان به عامل تبدیل \(\frac{{0/2molKI}}{{1LKI(aq)}}\) دست یافت.
\(?molKI = 0/25LKI(aq) \times \frac{{0/2molKI}}{{1LKI(aq)}} = 0/05molKI\)
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه دهم- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
حلال نمک در آب
حلال نمک در آب
آمارها نشان می دهند که نزدیک به 3 درصد از جمعیت کشورمان سنگ کلیه دارند. این بیماری افزون بر زمینۀ ژن شناختی می تواند به دلیل تغذیۀ نامناسب، کم تحرکی، مصرف بیش از حد نمک خوراکی، نوشیدن کم آب، مصرف پروتئین حیوانی و لبنیات و نیز اختلالات هورمونی ایجاد شود. آیا بین میزان حل شدن نمک ها در آب و تشکیل سنگ کلیه رابطه ای وجود دارد؟ برای پاسخ به این پرسش، دانستن و درک مفهوم انحلال پذیری ضروری است. شیمی دان ها بیشترین مقدار از یک حل شونده را که در 100 گرم حلال و دمای معنی حل می شود، انحلال پذیری آن ماده می نامند. در این عبارت، واژۀ (بیشترین) نشان دهندۀ رسیدن محلول به حالت سیرشده است، محلولی که نمی تواند حل شوندۀ بیشتری را در خود حل کند.
جدول انحلال پذیری برخی مواد در آب در دمای (\({25^0}C\) ) را نشان می دهد.
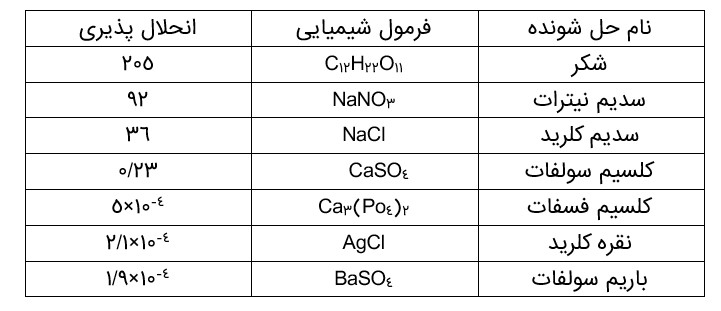
جدول نشان می دهد که در (\({25^0}C\) ) در 100g آب، هر مقدار کمتری از 36g سدیمکلرید می تواند در آب حل شود، اما یک محلول سیر نشده پدید می آید. در حالی که در این دما، حداکثر 36g سدیمکلرید می تواند در 100g آب حل شود تا 136g محلول سیر شده به دست آید. بدیهی است که در این دما برای تهیۀ محلول سیر شده ای از کلسیم سولفات باید 0/23g از آن را در 100g آب حل نمود.
انحلال پذیری نمک ها به نوع آنها و دما بستگی دارد اما تأثیر دما بر میزان انحلال پذیری آنها یکسان نیست به طوری که انحلال پذیری برخی نمک ها با افزایش دما، افزایش یافته و برخی دیگر کاهش می یابد.
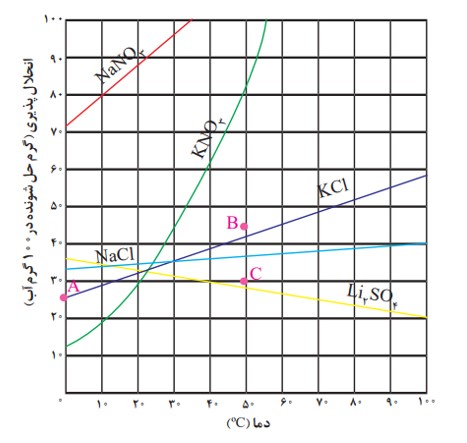
نمودار (انحلال پذیری ــ دما) نامیده می شود که برای هر نمک براساس آزمایش و از داده های تجربی آن به دست آمده است. مطابق این نمودار با افزایش دما، انحلال پذیری اغلب نمک ها افزایش می یابد.
جزوات جامع پایه دهم
جزوه جامع شیمی دهم فصل 1 کیهان زادگاه الفبای هستی
جزوه جامع شیمی دهم فصل 2 ردِّ پای گازها در زندگی
جزوه جامع شیمی دهم فصل 3 آب، آهنگ زندگی
رفتار آب و سایر مولکول ها در میدان الکتریکی
رفتار آب و سایر مولکول ها در میدان الکتریکی
آب تنها ماده ای است که به هر سه حالت جامد، مایع و گاز (بخار) در طبیعت یافت می شود. وجود و تبدیل این حالت ها به یکدیگر زندگی را در سیارۀ آبی ممکن و دلپذیر ساخته است. آب ویژگی های گوناگون و شگفت انگیزی دارد. از جملۀ آنها توانایی حل کردن اغلب مواد، افزایش حجم هنگام انجماد و داشتن نقطۀجوش بالا و غیر عادی است.
با آزمایش انحراف باریکۀ آب به وسیلۀ شانه یا میلۀ شیشه ای مالش داده شده به موهای خشک آشنا هستید آزمایشی که در آن باریکۀ آب از راستای طبیعی خود منحرف می شود. میلۀ شیشه ای از لحاظ بار الکتریکی خنثی است، اما بر اثر مالش به موی خشک، دارای بار الکتریکی منفی خواهد شد. در این شرایط مولکول های آب به سوی آن جذب می شوند.
این رفتار مولکول های آب از ویژگی های ساختاری آن سرچشمه می گیرد. شکل مولکول آب خمیده V) شکل( بوده و در آن هر اتم هیدروژن با یک پیوند اشتراکی یگانه به اتم مرکزی )اکسیژن) متصل است. نوع اتم های سازنده و ساختار خمیدۀ مولکول آب، نقش تعیین کننده ای در خواص آن دارد. هنگامی که این مولکول ها در یک میدان الکتریکی قرار می گیرند، جهت گیری می کنند.
شکل زیر جهت گیری مولکول های آب در میدان الکتریکی را نشان می دهد.
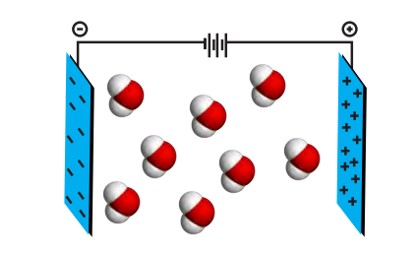
نحوۀ جهت گیری مولکول های آب در میدان الکتریکی نشان می دهد که اتم اکسیژن، سر منفی و اتم های هیدروژن، سر مثبت مولکول را تشکیل می دهند. شیمی دان ها به مولکول هایی مانند آب که در میدان الکتریکی جه تگیری می کنند، مولکول های دوقطبی یا قطبی می گویند. این درحالی است که مولکول های سازندۀ ترکیب هایی مانند گاز اکسیژن (O2)، کربن دی اکسید (CO2) و متان (CH4)در میدان الکتریکی جهت گیری نمی کنند. چنین مولکول هایی، ناقطبی نامیده می شوند.
نیرو های بین مولکولی
نیرو های بین مولکولی
نیروهای بین مولکولی در تعیین حالت فیزیکی و خواص یک ترکیب نقش مهمی دارند. گازها، دارای مولکول های مجزا با کمترین برهم کنش ها هستند. اما برهم کنش مولکول ها در مایع ها بیشتر است و در جامدها، برهم کنش ها میان مولکول ها می تواند به بیشترین مقدار ممکن برسد. از این رو در شرایط یکسان، نیروهای بین مولکولی در حالت جامد قوی تر از حالت مایع و آن هم به مراتب قوی تر از حالت گازی است. البته باید توجه داشت که نیروهای بین مولکولی به طور عمده به میزان قطبی بودن مولکول ها و جرم آنها وابسته است.
به برهم کن شهای میان مولکول های سازندۀ یک ماده، نیروهای بین مولکولی می گویند؛ نیروهایی که ذره های سازندۀ گاز به یکدیگر وارد می کنند یا نیروهایی که مولکول های مواد به حالت مایع و جامد را در کنار یکدیگر نگه می دارند.
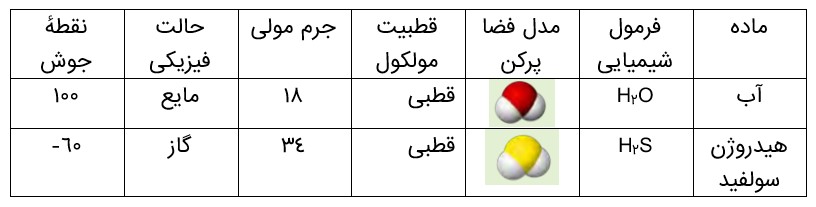
مطابق جدول، هر دو ماده مولکول های خمیده و قطبی دارند، اما آب با جرم مولی نزدیک به نصف جرم مولی هیدروژن سولفید، دمای جوش غیرعادی و بالاتری از آن دارد به طوری که تفاوتی برابر با \({160^0}C\) را نشان می دهد. گویی نیروی جاذبه میان مولکول های آب از آنچه انتظار می رود، قویتر است.
با جهت گیری مولکول های قطبی یک ماده در میدان الکتریکی آشنا شدید. این ویژگی مبنای اندازه گیری کمیتی به نام گشتاور دوقطبی است؛ کمیتی تجربی که با افزایش میزان قطبیت مولکول ها، افزایش می یابد. برای نمونه گشتاور دوقطبی مولکول هایی مانند 2O، 2COو 4CHبرابر با صفر است، در حالی که گشتاور دوقطبی مولکولهای H2O و H2S به ترتیب برابر با 1/85D و 0/97D است. این کمیت ها نشان می دهند که میزان قطبیت مولکول های آب و قدرت نیروهای بین مولکولی آن نزدیک به دو برابر مولکول های هیدروژن سولفید است. از این رو نیروهای جاذبه میان مولکولهای H2O به اندازه ای قوی است که در شرایط اتاق می تواند این مولکول ها را کنار یکدیگر نگه دارد و آب به حالت مایع باشد.
گشتاور دوقطبی (\(\mu \) ) مولکول ها را با یکای دبای (D) گزارش می کنند.
از آنجا که بارهای الکتریکی ناهمنام یکدیگر را می ربایند، در یک نمونه آب که دارای شمار بسیاری مولکول H2O است، سرمثبت هر مولکول، سرمنفی مولکول همسایه را جذب می کند. از این رو در مجموعه ای از مولکول های آب، هر اتم هیدروژن با یک نیروی جاذبۀ قوی از سوی اتم اکسیژن درمولکول همسایه جذب می شود. این نیروهای جاذبۀ قوی میان مولکول های آب که در آن هیدروژن نقش کلیدی ایفا می کند، پیوندهای هیدروژنی نامیده می شود.
به جز پیوندهای هیدروژنی، به نیروهای جاذبه بین مولکولی، نیروهای واندروالس می گویند.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه دهم- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
شکل های آب و پیوند های هیدروژنی
شکل های آب و پیوند های هیدروژنی
آب را در سه حالت فیزیکی جامد (یخ)، مایع و بخار در نظر بگیرید. مولکول های H2O در حالت بخار جدا از هم هستند، گویی پیوندهای هیدروژنی میان آنها وجود ندارد. در این حالت، مولکول های آب آزادانه و نامنظم از جایی به جای دیگر انتقال می یابند. در حالت مایع، با اینکه مولکول ها با یکدیگر پیوندهای هیدروژنی قوی دارند، اما روی هم می لغزند و جابه جا می شوند. برخلاف آب، ساختار یخ منظم است. در یخ، مولکول های آب در جاهای به نسبت ثابتی قرار دارند. درواقع در ساختار یخ، هر اتم اکسیژن به دو اتم هیدروژن با پیوند اشتراکی و به دو اتم هیدروژن دیگر با پیوند هیدروژنی متصل است.
در ساختار یخ، آرایش مولکول های آب به گونه ای است که در آن، اتم های اکسیژن در رأس حلقه های شش ضلعی قرار دارند و شبکه ای مانند کندوی زنبور عسل را به وجود می آورند. این شبکه با داشتن فضاهای خالی منظم، در سه بعد گسترش یافته است. شکل های زیبا و متنوع دانه های برف ناشی از وجود این حلقه های شش ضلعی است.
جزوات جامع پایه دهم
جزوه جامع شیمی دهم فصل 1 کیهان زادگاه الفبای هستی
جزوه جامع شیمی دهم فصل 2 ردِّ پای گازها در زندگی
جزوه جامع شیمی دهم فصل 3 آب، آهنگ زندگی
آب و سایر حلال ها
آب و سایر حلال ها
آب فراوان ترین و رایج ترین حلال در طبیعت، صنعت و آزمایشگاه است، زیرا می تواند بسیاری از ترکیب های یونی و مواد مولکولی را در خود حل کند. آب و محلول های آبی در زندگی جانداران نقش حیاتی دارند. اما همۀ محلول ها آبی نیستند زیرا افزون بر آب، حلال های دیگری نیز وجود دارند. جدول زیر سه ترکیب آلی را نشان می دهد که به عنوان حلال به کار می روند.
سه حلال آلی و برخی ویژگی های آن ها
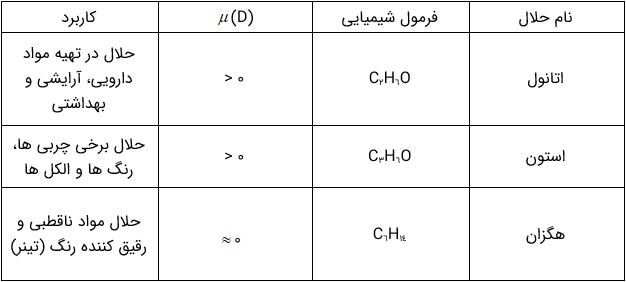
به محلول هایی که حلال آنها آلی است، محلول های غیر آبی می گویند.
1 هوا و آب دریا از جمله محلول هایی هستند که از یک حلال و چند حل شونده تشکیل شده اند.
2 برخی مواد شیمیایی مانند اتانول )الکل معمولی) و استون به هر نسبتی در آب حل می شوند. از این رو نمی توان محلول سیرشده ای از آنها تهیه کرد.
3 گشتاور دو قطبی اغلب هیدروکربن ها ناچیز و در حدود صفر است.
مواد محلول ساز
مواد محلول ساز
برخی حل شونده ها در برخی حلال ها حل می شوند و محلول تشکیل می دهند، در حالی که برخی دیگر مخلوط ناهمگن می سازند. برای نمونه، افزودن استون به آب یا اندکی یُد به هگزان منجر به تشکیل محلول می شود؛ اما، افزودن هگزان به آب، مخلوطی ناهمگن پدید می آورد.
اگر مولکول های حلال را با A و ذره های حل شونده را با B نمایش دهیم، می توان نیروهای جاذبه میان آن ها را در حالت خالص باA…..A و B…..Bنشان داد. با این توصیف برای محلول B در A رابطه زیر برقرار است.
\((A....B) > \frac{{(A....A) + (B....B)}}{2}\)
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه دهم- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
فرایند انحلال نمک ها در آب
فرایند انحلال نمک ها در آب
با انحلال مولکولی آشنا شدید. انحلالی که در آن مولکول های حل شونده، ماهیت خود را در محلول حفظ می کنند، گویی ساختار مولکول های حل شونده در محلول دچار تغییر نشده است. انحلال استون یا اتانول در آب و نیز انحلال یُد در هگزان از این نوع هستند. اما همۀ فرایندهای انحلال چنین نیستند، برای نمونه به فرایند انحلال سدیم کلرید در آب توجه کنید.
سدیم کلرید یک ترکیب یونی با بلورهای مکعبی است که در آن یون های Na+ و Cl- با آرایشی منظم در سه بعد جای گرفته اند. هنگامی که بلور کوچکی از این مادۀ جامد در آب وارد می شود، مولکول های قطبی آب از سرهای مخالف به یون های بیرونی بلور نزدیک شده، نیروی جاذبه ای میان آنها برقرار می شود. این نیروی جاذبه، یون ــ دوقطبی نام دارد؛ نیروی جاذبه ای که باعث جدا شدن یون ها از شبکه شده تا با لایه ای از مولکول های آب، پوشیده شوند. این یون های آب پوشیده در سر تا سر محلول پراکنده خواهند شد، به طوری که محلول آب نمک را می توان محلولی محتوی یون های Na+(aq) و Cl-(aq) دانست. در این فرایند انحلال، مادۀ حل شونده ویژگی ساختاری خود را حفظ نکرده است و یون های سازندۀ شبکۀ بلور یونی، تفکیک و آب پوشیده شده اند. این فرایند، انحلال یونی به شمار می رود.
جزوات جامع پایه دهم
جزوه جامع شیمی دهم فصل 1 کیهان زادگاه الفبای هستی
جزوه جامع شیمی دهم فصل 2 ردِّ پای گازها در زندگی
جزوه جامع شیمی دهم فصل 3 آب، آهنگ زندگی
انحلال پذیری گازها در آب
انحلال پذیری گازها در آب
نوع گاز
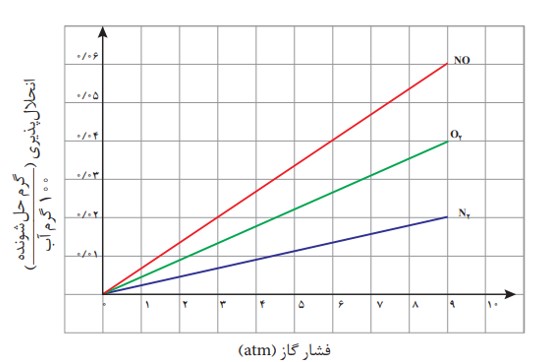
گازهایی که مولکول های ناقطبی دارند اغلب انحلال پذیری کمی در آب دارند مانند گازهای 2Oو N2، هر چه مولکول ناقطبی بزرگ تر و سنگین تر باشند جاذبه ی قوی تری با آب ایجاد می کند و انحلال پذیری آن در آب بیش تر است به عنوان مثال انحلال پذیری گاز نیتروزن از گاز هیدروژن بیش تر است.
دما
انحلال پذیری گازها با دما رابطه ی عکس دارد یعنی با کاهش دما انحلال پذیری گازها افزایش می یابد به همین علت ماهی ها در هوای گرم به سطح آب می آیند چون در هوای گرم انحلال پذیری گاز اکسیژن در آب کاهش می یابد.
فشار
برای این که یک گاز بتواند در آب یا حلال دیگر حل شود باید ذره های آن لا به لای مولکول های آب قرار گیرند که با افزایش فشار تعداد بیش تری ذره های گاز در سطح آب قرار می گیرند برهم کنش آن ها با مولکول های آب بیش تر می شود در نتیجه انحلال پذیری آن ها افزایش می یابد. اثر افزایش فشار بر انحلال پذیری گازها نخستین بار توسط ویلیام هنری در سال 1803 میلادی بررسی شد به همین علت به قانون هنری معروف است که طبق این قانون انحلال پذیری گازها با فشار رابطه مستقیم دارد در دمای ثابت با افزایش فشار انحلال پذیری گازها افزایش می یابد نمودار انحلال پذیری گازها برحسب فشار به صورت خطی با شیب ثابت و مثبت است و انحلال پذیری گازها در دمای صفر درجه برابر صفر است یعنی عرض از مبدا نمودار انحلال پذیری گازها برحسب فشار برابر صفر است و معادله ی انحلال پذیری برحسب فشار به صورت \(S = K \times P\) می باشد به عنوان مثال اگر فشار یک گاز را دو برابر کنیم انحلال پذیری آن دو برابر می شود ولی نمودار انحلال پذیری گازها برحسب دما به صورت منحنی بوده و شیب آن در دماهای مختلف متفاوت است.
اثر مقدار ماده حل شونده
با افزایش مقدار یک ماده حل شونده انحلال پذیری گازها در آن محلول کم می شود زیرا یون ها یا مولکول های ماده حل شونده در آب با مولکول های آب نیروی جاذبه ی قوی یون - دوقطبی تشکیل می دهند بنابراین تمایل مولکول های آب به جذب مولکول های گاز کم می شود به هم علت وقتی که شما یک حبه قند و یا مقداری نمک داخل نوشابه می ریزید مقداری از گاز نوشابه خارج می شود.
یون پتاسیم در بدن
یکی از مهم ترین یون ها در مایع های بدن، یون پتاسیم K+ نیاز روزانه بدن هر فرد بالغ به یون پتاسیم دو برابر یون سدیم است. از آنجا که بیشتر مواد غذایی حاوی یون پتاسیم K+ برای تنظیم و عملکرد مناسب است، کمبود آن به ندرت احساس می شود. وجود یون پتاسیم دستگاه عصبی بسیار ضروری است به طوری که انتقال پیام های عصبی بدون وجود این یون، امکان پذیر نیست. درواقع، اختلال در حرکت این یون مانع از انتقال پیام های عصبی و گاهی در موارد شدید منجر به مرگ می شود.
ردپای آب در زندگی
ردپای آب در زندگی
هر فرد، روزانه در حدود 350 لیتر آب مصرف می كند. این مقدار آب افزون بر نوشیدن، شامل پخت و پز ، شستشو در آشپزخانه، نظافت، شستشوی لباس و .... است. مصرف آب به فعالیت های روزانه هر شخص محدود نمی شود، بلكه روزانه در صنایع گوناگون، حجم بسیار زیادی آب استفاده می شود. در میان صنایع، صنعت كشاورزی بیشترین حجم آب مصرفی را به خود اختصاص داده است. بررسی ها نشان می دهند كه برای تولید هر وسیله، كالا یا فراورده مقدار معینی آب نیاز است.
همانند ردپای کربن دی اکسید، برای هر فرد، ردپای آب نیز تعریف می شود. درواقع، ردپای آب نشان می دهد كه هر فرد چه مقدار از آب قابل استفاده و در دسترس مصرف می کند و در نتیجه چه مقدار از حجم منابع آب کم می شود. این میزان، همۀ آبی را كه در تولید كالاها، ارائه خدمات و فعالیت های گوناگون مصرف می شود، نشان می دهد. برای مثال اگر شما سالانه 150كیلوگرم گندم مصرف كنید، ردپای آب شما در تولید این مقدار گندم برابر با 274500 لیتر خواهد بود. با حساب كردن همۀ آب مصرفی در زندگی سالانه هر فرد می توان میانگنی ردپای آب او را برآورد كرد. هر چه رد پای آب ایجاد شده، سنگین تر باشد، منابع آب شیرین بیشتر مصرف می شوند و زودتر به پایان می رسند. برآوردهای پژوهشگران نشان می دهد که میانگین ردپای آب برای هر فرد در یک سال در حدود 1000000 لیتر است.
این ردپا شامل همه آب های مصرفی در کشاورزی، دامداری، نساجی، بهداشت، خانه، مدرسه، دانشگاه و... است که همگی از آب های سطحی یا زیرزمینی تأمین می شود. توجه کنید که آب آشامیدنی با آب مصرفی در دیگر صنایع متفاوت است؛ به طوریكه ممكن است آبی برای شستشو مناسب باشد اما آشامیدنی نباشد. هر چند كه آب دریاها و اقیانوس ها، منبع بسیار بزرگی برای تهیۀ آب به شمار می آیند، اما به اندازه ای شور هستند كه باید قبل از مصرف، نمك زدایی و تصفیه شوند.
اسمز در زندگی
هنگامی كه حبوبات و میوه های خشك را برای مدتی درون آب قرار می دهیم، متورم می شوند در حالی كه خیار در آب شور چروكیده می گردد.
دیوارۀ یاخته ها در گیاهان روزنه هایی بسیار ریز دارد كه ذره های سازندۀ مواد می توانند از آن گذر كنند. به گونه ای كه این روزنه ها فقط اجازۀ گذر به برخی از ذره ها و مولكول های كوچك مانند آب و یون ها را می دهند و از گذر مولكول های درشت تر جلوگیری می كنند. این دیواره ها غشای نیمه تراوا نامیده می شوند.
1 هنگـامی كه میـوه هـای خشك مانند مویز درون آب قرار می گیرند، مولكول هـای آب، خـود بـه خـود از محیط رقیق با گذر از روزنه های دیوارۀ سلولی به محیط غلیظ می روند. در نتیجه، میوه آبدار و متورم می شود.
2 گذرندگی (اسمز) نامی است که به این فرایند داده اند. در این فرایند، برخی نمك ها ، ویتامین ها و ... از بافت میوه به آب راه می یابد.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه دهم- آزمون آنلاین تمامی دروس پایه دهم
- گام به گام تمامی دروس پایه دهم
- ویدئو های آموزشی تمامی دروس پایه دهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دهم
- فلش کارت های آماده دروس پایه دهم
- گنجینه ای جامع از انشاء های آماده پایه دهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دهم
اسمز و اسمز معکوس
اسمز و اسمز معکوس
اگر حجم های یکسانی از آب خالص و محلول آب نمک توسط یک غشای نیم تراوا (غشایی مانند سلوفان که برخی از مولکول ها، نه همه آن ها، را از خود عبور می دهد، غشای نیمه تراوا نامیده می شود) جدا شده باشند غشایی که فقط مولکول های آب بتواند از درون آن بگذرد و یون های سدیم و کلر نتواند عبور کنند در این حالت مولکول های آب در هر دو جهت حرکت می کنند ولی سرعت حرکت این مولکول ها از سمت آب خالص به سمت محلول آب نمک بیش تر است چون تعداد مولکول های آب در آب خالص نسبت به محلول آب نمک بیش تر است. به حرکت مولکول های آب از درون یک غشای نیمه تراوا از سمت محلول رقیق تر به سمت محلول غلیظ تر و یا از سمت حلال خالص به سمت محلول، اسمز می گویند که با گذشت زمان حجم محلول غلیظ تر افزایش و حجم محلول رقیق تر کاهش می یابد.
اگر حجم های یکسانی از آب خالص و محلول آب نمک توسط یک غشای نیم تراوا جدا شده باشند و روی سطح محلول آب نمک فشاری بیش تر از فشار اسمزی وارد کنیم در این حالت مولکول های آب در هر دو جهت حرکت می کنند ولی سرعت حرکت این مولکول ها از سمت محول آب نمک به سمت آب خالص بیش تر است چون فشار وارد بیش تر از فشار اسمزی است یعنی آب از محلول غلیظ تر جدا شده و پس از عبور از غشا نیم تراوا به طرف محلول رقیق تر می رود به همین علت به این فرآیند اسمز معکوس می گویند. که با گذشت زمان حجم محلول غلیظ تر کاهش و حجم آب خالص افزایش می یابد. فرآیند اسمز معکوس برای تولید آب شیرین از آب دریا به کار می رود.



1736019749.png)















