درسنامه کامل فیزیک دهم ریاضی فصل 4 دما و گرما
تعداد بازدید : 7.59Mخلاصه نکات فیزیک دهم ریاضی فصل 4 دما و گرما - درسنامه شب امتحان فیزیک دهم ریاضی فصل 4 دما و گرما - جزوه شب امتحان فیزیک دهم ریاضی نوبت اول فصل 4 دما و گرما
انواع دماسنج
انواع دماسنج
دما چیست؟
دما کمیتی است که میزان گرمی و سردی اجسام را مشخص می کند.
ساده ترین و رایج ترین نوع دماسنج، دماسنج های جیوه ای و الکلی است.
کمیت دماسنجی:
هر مشخصه قابل اندازه گیری که با گرمی و سردی جسم تغییر می کند. کمیت دماسنجی می گویند.
چند مثال از کمیت دماسنجی
ارتفاع مایع، فشار، حجم، رنگ، جریان الکتریکی و ... .
تعبیر مولکولی دما و انرژی درونی
انرژی درونی:
به مجموع انرژی های جنبشی و پتانسیل مولکولی تمام ذره های جسم، انرژی درونی گفته می شود.
دمای هر جسم:
متناسب با انرژی جنبشی متوسط مولکول های سازنده ی آن است.
انرژی درونی به جرم و دمای جسم وابسته است.
وقتی دمای جسمی کاهش یا افزایش می یباد، انرژی درونی آن کاهش یا افزایش یافته است.
در تغییر حالت های جسم (ذوب، تبخیر) انرژی درونی جسم تغییر می کند، اما دمای جسم تغییر نمی کند.
دماسنج های معمولی بر اساس انبساط و انقباض مایع درون دماسنج (جیوه و الکل) است.
نقاط ثابت دماسنجی در مقیاس سلسیوس:
دمای یخ خالص در حال ذوب و دمای جوش آب خالص، هر دو در فشار یک اتمسفر به عنوان نقاط ثابت دماسنجی در مقیاس سلسیوس انتخاب شده اند و به آن ها به ترتیب دمای صفر و صد نسبت داده شده است. درجه ی سلسیوس را با نماد (\({}^0C\) ) نشان می دهیم.
در SI یکای دما برحسب کلوین است که با نماد K نمایش داده می شود، دما برحسب کلوین را با نماد (T) و برحسب درجه سلسیوس را با نماد (\(\theta \)) (تتا) نشان می دهیم.
رابطه بین دما در مقیاس های کلوین و سلسیوس
\({T_{\left( k \right)}} = {\theta _{\left( {{}^0C} \right)}} + 273\)
صفر کلوین معادل \( - 273{}^0C\) است.
صفر مطلق
پایین ترین دمای ممکن که برابر \( - 273{}^0C\) است را صفر مطلق می گویند.
مقایسه سه یکای دماسنجی: سلسیوس، فارنهایت و کلوین
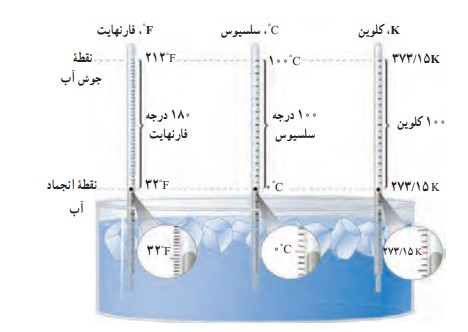
مقایسه یکاهای فارنهایت، سلسیوس و کلوین
رابطه بین یکای سلسیوس و یکای فارنهایت
\({F_{\left( F \right)}} = 1/8{\theta _{\left( {{}^0C} \right)}} + 32\)
مثال
\(27{}^0C\) چند کلوین و چند درجه فارنهایت است؟
\(\begin{array}{l}\theta = {27_{\left( {{}^0C} \right)}}\\T = ?\\F = ?\\{T_{\left( K \right)}} = {\theta _{\left( {{}^0C} \right)}} + 273 \to T = 27 + 273 \to T = 300K\\{F_{\left( F \right)}} = 1/8{\theta _{\left( {{}^0C} \right)}} + 32 \to F = 1/8 \times 27 + 32 \to F = 80/6F\end{array}\)
ویژگی های مقیاس کلوین:
1) صفر کلوین کمترین دمای ممکن است یعنی در مقیاس کلوین دمای منفی ندارد.
2) تغییر دما در مقیاس سلسیوس با تغیر دما در مقیاس کلوین برابر است:
\(\Delta {T_K} = \Delta {\theta _{{}^0C}}\)
3) در دمای صفر کلوین انرژی جنبشی و انرژی درونی ذرات به کمترین مقدار خود می رسد. اما برابر صفر نیست.
1 اگر دما یک درجه سلسیوس تغییر کند. در درجه بندی فارنهایت \(1/8{}^0F\) تغییر خواهد کرد.
2 در دمای \(F \approx - 12/3{}^0F\) یکای فارنهایت نصف عدد دمای سلسیوس است.
مدرج ساختن دماسنج با یک مقیاس دلخواه:
اگر دماسنجی وجود داشته باشد که نقطه ذوب یخ را با a و نقطه جوش آب را با b نشان دهد. برای مدرج کردن آن بایستی فاصله بین این دو مقدار را به b-a قسمت مساوی تقسیم کنیم. حال می خواهیم بدانیم این دماسنج دمایی را که دماسنج سلسیوس برابر \(\theta \) نشان می دهد، چقدر (X) نشان خواهد داد؟
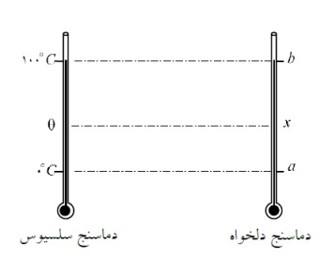
\(\frac{{x - a}}{{b - a}} = \frac{{{\theta _{\left( {{}^0C} \right)}} - 0}}{{100 - 0}}\)
مثال
دماسنجی که دمای نقطه ی ذوب یخ را 20- و دمای نقطه ی جوش آب را 105 درجه نشان می دهد، دمای یک محیط را 5 درجه نشان می دهد. دماسنجی که برحسب درجه ی سلسیوس درجه بندی شده است. دمای این محیط را چند درجه نشان می دهد؟
\(\frac{{x - {x_1}}}{{{x_2} - {x_1}}} = \frac{{\theta - {\theta _1}}}{{{\theta _2} - {\theta _1}}} \to \frac{{5 + 20}}{{105 + 20}} = \frac{{\theta - 0}}{{100 - 0}} \to \frac{{25}}{{125}} = \frac{\theta }{{100}} \to \theta = 20{}^0c\)
دماسنج های معیار
- دماسنج گازی: اساس کار این دماسنج ها بر مبنای قانون گاز های کامل است.
- دما سنج های مقاومت پلاتینی: اساس کار این دماسنج ها بر مبنای تغییر مقاومت باد ما است.
- تف سنج (پیرومتر): اساس کار این دماسنج ها بر مبنای تابش گرمایی است.
علت نام گذاری دماسنج های معیار:
- کاربرد این دماسنج ها در صنعت و آزمایشگاه زیاد است.
- دقت اندازه گیری این دماسنج ها زیاد است، یعنی در محدوده ی یک هزارم درجه و کمتر از آن دما را می توانند اندازه بگیرند.
ترموکوپل:
وسیله ای برای اندازه گیری دماست که بر اساس تغییر ولتاژ ناشی از اختلاف دمای دو سر دار تشکیل دهنده ی آن کار می کند.
ساختمان ترموکوپل
دو سیم فلزی غیر همجنس مانند مس و کنستانتان از یک و در ظرف مخلوط آب و یخ با دمای ثابت صفر درجه نگه داشته شده اند و از طرف دیگر به جسمی با دمای مجهول متصل اند. و به وسیله دو سیم مسی به ولت سنج بسته می شوند. با افزایش دمای مجهول ولتاژ دو سر سیم های غیر هم جنس افزایش می یابد. با اندازه گیری ولتاژ مربوط به هر دما می توان دمای مجهول را مشخص کرد.
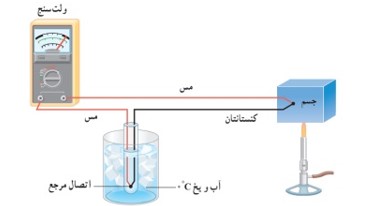
برتری های داسنج ترموکوپل نسبت به دماسنج های دیگر:
- دقت اندازه گیری آن زیاد است. (اما دقت آن کمتر از دما سنج های معیار است.)
- تغیرات ناگهانی دما را خیلی سریع و پیوسته نشان می دهد.
- گستره ی دماسنج ترموکوپل به جنس سیم ها بستگی دارد، مثلا برای جنس سیم از آلیاژ خاص گستره ی دماسنجی \( - 270{}^0C\) تا \(1372{}^0C\) است.
- در بسیاری از وسایل صنعتی، گرمایشی و سرمایشی یافت می شود.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه ریاضی- آزمون آنلاین تمامی دروس پایه ریاضی
- گام به گام تمامی دروس پایه ریاضی
- ویدئو های آموزشی تمامی دروس پایه ریاضی
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه ریاضی
- فلش کارت های آماده دروس پایه ریاضی
- گنجینه ای جامع از انشاء های آماده پایه ریاضی
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه ریاضی
انبساط طولی، سطحی و حجمی
انبساط طولی، سطحی و حجمی
انبساط جامد ها:
با افزایش دما، دامنه ی نوسان مولکول ها و اتم های ماده و ئر نتیجه فاصله متوسط آنها از یکدیگر افزایش یافته و جسم جامد منبسط می شود.
انواع انبساط ها
اکثر اجسام در اثر افزایش دما، منبسط می شود. این انبساط به صورت های زیر است:
1) انبساط جامد ها
الف) طولی
ب) سطحی
ج) حجمی
2) انبساط مایع ها
3) انبساط گاز ها (قانون گاز ها)
1) انبساط جامد ها
الف) طولی
افزایش دما باعث افزایش طول جامد ها می شود. انبساط طولی اجسام مختلف به دلیل تفاوت جنسشان با یکدیگر متفاوت است.
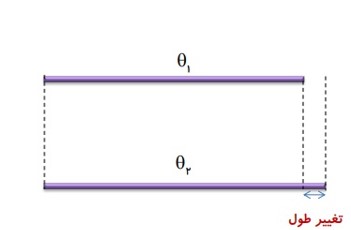
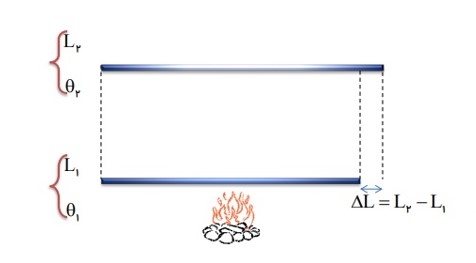
تغییر طول یک میله ی جامد، به عوامل زیر بستگی دارد:
- به طول اولیه \({L_1}\)
- تغیرات دما \(\Delta \theta \)
- جنس میله (ضریب انبساط طولی) \(\alpha \)
ضریب انبساط طولی (آلفا \(\alpha \))
افزایش طول واحد طول (\(1m\) ) یک جسم جامد وقتی که دمای آن یک کلوین (یا سانتی گراد) بالا رود.
\(\alpha = \frac{{\Delta L}}{{{L_1}\Delta \theta }} \to \alpha = \frac{{\Delta L}}{{1m \times 1{}^0C}}\)
فرمول انبساط طولی
\(\begin{array}{l}\Delta L = \alpha {L_1}\Delta \theta \to {L_2} - {L_1} = \alpha {L_1}\Delta \theta \to {L_2} = {L_1} + \alpha {L_1}\Delta \theta \\1)\Delta L = \alpha {L_1}\Delta \theta \\2){L_2} = {L_1}\left( {1 + \alpha \Delta \theta } \right)\end{array}\)
جنبه های مختلف انبساط گرمایی در زندگی
جنبه های مفید: اساس کار دماسنج ها و ترموستات ها، انبساط گرمایی است.
جنبه های دردسر ساز انبساط طولی:
انبساط طولی در ساختن پل ها، ساختمان ها، خط راه آهن، خطوط نیرو و سوخت مشکل ایجاد می کند.
مثال
ارتفاع برج ایفل در یک روز از سال \(301m\) است اگر اختلاف دما در آن روز \(22{}^0C\) باشد. افزایش طول این برج چقدر است؟ (\(\alpha = 10/5 \times {10^{ - 6}}{\textstyle{1 \over {{}^0C}}}\) )
\(\begin{array}{l}{L_1} = 301m\\\Delta \theta = 22{}^0C\\\alpha = 10/5 \times {10^{ - 6}}{\textstyle{1 \over {{}^0C}}}\\\Delta L = ?\\\Delta L = \alpha {L_1}\Delta \theta \\\Delta L = 10/5 \times {10^{ - 6}} \times 301 \times 22 \to \Delta L \approx 0/07m = 7cm\end{array}\)
دماپا (ترموستات):
وسیله ای برای تنظیم دماست که از دو فلز غیر هم جنس با میزان انبساط متفاوت که به یک دیگر پرچ یا لحیم شده اند، ساخته شده است.
در اتوی برقی
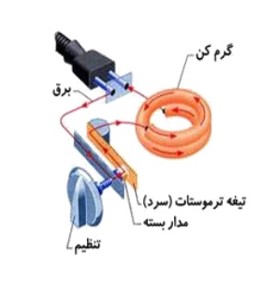
1 اگر دماپا (نوار دو فلز) در یک مدار الکتریکی قرار دهیم با بر قراری جریان نوار دو فلز گرم می شود و نوار خم شده و اتصال قطع می شود و اگر دماپا سرد شود دوباره طول دو فلز یک اندازه می شود و نقاط اتصال وصل می شوند و دستگاه روشن می شود.
2 هرچه آلفا (ضریب انبساط طولی) بزرگتر باشد افزایش طول میله به علت افزایش دما بیشتر است.
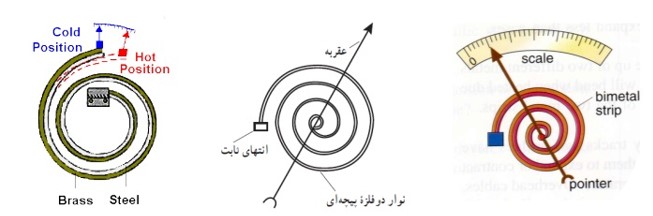
دماسنج نواری دو فلز (بی متال)
این نوع دماسنج مثل ترموستات از دو تیغه ی فلزی با ضریب انبساط متفاوت که سر تا سر به هم جوش داده شده اند، می سازند.
در دماسنج بی متال تیغه های فلزی به شکل یک نوار حلزونی است. در ن جا هم تیغه ی فلزی که ضریب انبساط بیشتری دارد کمان خارجی را تشکیل می دهد به همین دلیل با افزایش دما، نوار بی متال حلزونی، خمیده شده و عقربه به سمت راست می چرخد.
1) انبساط جامد ها
ب) انبساط سطحی:
افزایش دما باعث افزایش سطح جامد ها نیز می شود.
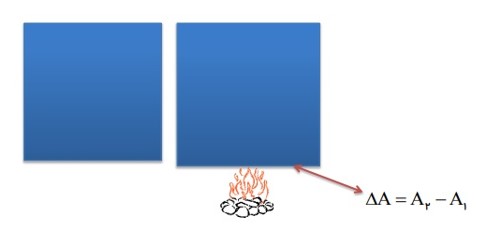
تغییر مساحت یک ورقه فلزی به عوامل زیر بستگی دارد:
- به مساحت اولیه \({A_1}\)
- تغییرات دما \(\Delta \theta \)
- ضریب انبساط سطحی ورقه \(2\alpha \)
فرمول ضریب انبساط سطحی
\(\begin{array}{l}1)\Delta A = 2\alpha {A_1}\Delta \theta \\2){A_2} = {A_1}\left( {1 + 2\alpha \Delta \theta } \right)\end{array}\)
ضریب انبساط سطحی: (\(2\alpha \) )
افزایش مساحت واحد سطح (\(1{m^2}\) ) یک جسم جامد وقتی که دمای آن یک کلوین (یا سانتی گراد) بالا رود.
\(2\alpha = \frac{{\Delta A}}{{{A_1}\Delta \theta }} \to 2\alpha = \frac{{\Delta A}}{{1{m^2} \times 1{}^0C}}\)
مثال
دمای یک صفحه فلزی \( - 10{}^0C\) است. دمای آن را به چند درجه سلسیوس برسانیم تا مساحتش به اندازه ی \(0/003\) سطح اولیه کاهش می یابد؟ (\(\alpha = 3 \times {10^{ - 5}}{\textstyle{1 \over {{}^0C}}}\) )
\(\begin{array}{l}{\theta _1} = - 10{}^0C\\{\theta _2} = ?\\\Delta A = - 0/003{A_1}\\\alpha = 3 \times {10^{ - 5}}{\textstyle{1 \over {{}^0C}}}\\\Delta A = 2\alpha {A_1}\Delta \theta \\ \to - 0/003{A_1} = 2 \times 3 \times {10^{ - 5}} \times {A_1} \times \Delta \theta \\ \to - 3 \times {10^{ - 3}} = 6 \times {10^{ - 5}} \times \Delta \theta \to \Delta \theta = \frac{{ - 3 \times {{10}^{ - 3}}}}{{6 \times {{10}^{ - 5}}}} = - 50\\{\theta _2} - {\theta _1} = - 50 \to {\theta _2} + 10 = - 50 \to {\theta _2} = - 50 - 10 = - 60{}^0C\end{array}\)
1) انبساط جامد ها
ج) انبساط حجمی
افزایش دما باعث افزایش حجم جامد ها نیز می شود.
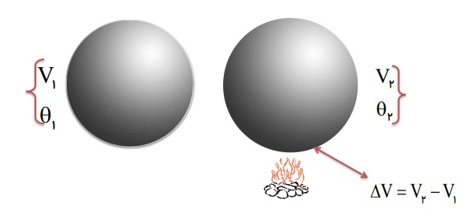
تغییر حجم یک جسم جامد به عوامل زیر بستگی دارد:
1) به حجم اولیه ی \({V_1}\)
2) تغیرات دما \(\Delta \theta \)
3) ضریب انبساط حجمی جسم \(3\alpha \)
فرمول انبساط حجمی جامدات
\(\begin{array}{l}1)\Delta V = 3\alpha {V_1}\Delta \theta \\2){V_2} = {V_1}\left( {1 + 3\alpha \Delta \theta } \right)\end{array}\)
ضریب انبساط حجمی: (\(3\alpha \) )
افزایش حجم واحد حجم (\(1{m^3}\) ) یک ماده وقتی که دمای آن یک کلوین (یا سانتی گراد) بالا رود.
\(3\alpha = \frac{{\Delta V}}{{{V_1}\Delta \theta }} \to 3\alpha = \frac{{\Delta V}}{{1{m^3} \times 1{}^0C}}\)
محاسبه درصد تغییرات طول، سطح و جسم:
درصد تغیرات طول
\(\frac{{\Delta L}}{{{L_1}}} \times 100\% = \left( {\alpha \times \Delta \theta } \right) \times 100\% \)
درصد تغیرات سطح
\(\frac{{\Delta A}}{{{A_1}}} \times 100\% = \left( {2\alpha \times \Delta \theta } \right) \times 100\% \)
درصد تغیرات حجم
\(\frac{{\Delta V}}{{{V_1}}} \times 100\% = \left( {3\alpha \times \Delta \theta } \right) \times 100\% \)
درصد تغییرات سطح دو برابر درصد تغییرات طولش و درصد تغییرات حجم سه برابر درصد تغییرات طولش است.
2) انبساط حجمی مایع ها
با افزایش دمای مایع، حرکت کاتوره ای اتم ها و مولکول ها افزایش می یابد. در نتیجه اتم ها و مولکول ها از هم دور شده و حجم مایع بیشتر می شود.
انبساط و انقباض مایعات تنها از نوع انبساط و انقباض حجمی است.
انبساط واقعی مایع = انبساط ظاهری مایع + انبساط ظرف
1 همیشه انبساط واقعی مایع از انبساط ظاهری مایع بیشتر است.
2 ضریب انبساط حجمی مایعات بسیار بزرگتر از ضریب انبساط حجمی جامدات است، بنابراین انبساط مایع بیشتر از انبساط ظرف است.
انبساط واقعی مایع
اگر حجم اولیه ی مایع را \({V_1}\) بنامیم تغییر حجم واقعی مایع در اثر تغییر دمای \(\Delta \theta \) از رابطه ی رو به رو محاسبه می شود:
\(\begin{array}{l}1)\Delta V = \beta {V_1}\Delta \theta \\2){V_2} = {V_1}\left( {1 + \beta \Delta \theta } \right)\end{array}\)
در فرمول دوم
(\({V_2}\)) حجم نهایی مایع
(\({V_1}\)) حجم اولیه مایع
(\(\beta \)) ضریب انبساط حجمی مایع
(\(\Delta \theta \) ) تغیرات دما است.
انبساط ظاهری مایع
تفاضل انبساط واقعی مایع از انبساط ظرف (انبساط ظاهری مایع) بدست می آید.
\(\begin{array}{l}1)\Delta V = \beta '{V_1}\Delta \theta \\2)\beta ' = \beta - 3\alpha \end{array}\)
در این فرمول
(\(\beta '\) ) ضریب انبساط ظاهری مایع
(\(\beta \)) ضریب انبساط واقعی مایع
(\(3\alpha \) ) ضریب انبساط حجمی ظرف
با افزایش دما، جرم جسم ثابت و حجم آن افزایش می یابد. بنابراین طبق رابطه \(\rho = \frac{m}{v}\) چگالی جسم کاهش می یابد.
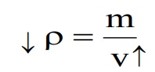
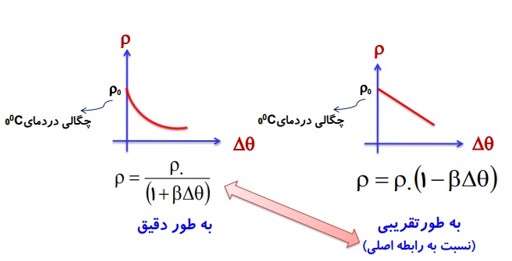
رابطه چگالی اجسام با دما:
\({\rho _2} = {\rho _1}\left( {1 - \beta \Delta \theta } \right)\)
نمودار تغییرات چگالی بر حسب دما (برای تمام مواد غیر از آب)
مثال
اگر دمای الکل را \(50{}^0C\) افزایش دهیم چگالی آن چقدر می شود؟
(\({\beta _{Alc}} = 1/1 \times {10^{ - 3}}{\textstyle{1 \over {{}^0C}}}\) و \({\rho _{Alc}} = 800\frac{{Kg}}{{{m^3}}}\) )
\(\begin{array}{l}\Delta \theta = 50{}^0C\\{\rho _2} = ?\\{\rho _1} = 800\frac{{Kg}}{{{m^3}}}\\\beta = 1/1 \times {10^{ - 3}}{\textstyle{1 \over {{}^0C}}}\\{\rho _2} = {\rho _1}\left( {1 - \beta \Delta \theta } \right)\\{\rho _2} = 800 \times \left( {1 - 0/0011 \times 50} \right) = 800 \times \left( {1 - 0/055} \right)\\{\rho _2} = 756\frac{{Kg}}{{{m^3}}}\end{array}\)
درصد تغیرات چگالی:
\(\frac{{\Delta \rho }}{{{\rho _1}}} \times 100\% \)
انبساط غیر عادی آب
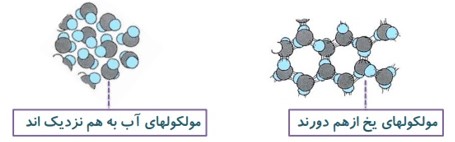
حجم بیشتر مایع ها با کاهش دما، کاهش می یابد ولی آب، رفتاری متفاوت دارد.
وقتی مقدار مشخصی از آب را سرد می کنیم تا دمای آن به \(4{}^0C\) برسد، حجم آن طبق روال عادی کاهش می یابد.
آب از دمای 4 درجه تا صفر درجه افزایش حجم پیدا می کند و در دمای \(4{}^0C\) حجم آن کمترین مقدار را دارد.
تغیرات چگالی با دما
با افزایش دما جرم جسم ثابت می ماند.
با توجه به اینکه افزایش دما، حجم جسم را افزایش می دهد، می توان گفت افزایش دما چگالی را کاهش می دهد زیرا؛ چگالی با حجم رابطه وارون دارند.
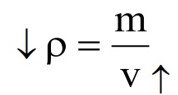
تغیرات چگالی آب با دما
حجم آب در \(4{}^0C\) کمترین مقدار خود را دارد، در نتیجه چگالی آب در \(4{}^0C\) نیز به بیشترین مقدار خود می رسد.
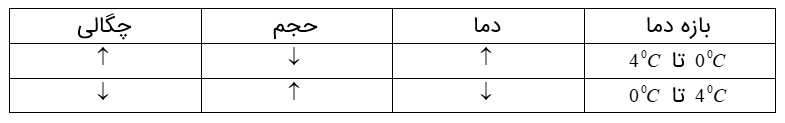
دلیل رفتار غیر عادی آب در محدوده دمایی \(4{}^0C\) تا \(4{}^0C\) :
آرایش مولکولی آب در بلور یخ به گونه ای است که در بعضی از نقاط مولکول به هم نزدیک و در بعضی نقاط از هم دور اند و بین آنها فضای خالی وجود دارد. در \(4{}^0C\) تقریبا تمام ساختار مولکولی بلور یخ از بین می رود و فضای خالی پر و آرایش مولکول های یکنواخت می شود. که این رفتار منجر به کاهش حجم و افزایش چگالی می شود. در محدوده \(0{}^0C\) تا \(4{}^0C\) بقایای ساختار مولکولی یخ هنوزوجود دارد و این باعث می شود آب، رفتاری غیر عادی داشته باشد.
جزوات جامع پایه ریاضی
جزوه جامع فیزیک دهم ریاضی فصل 1 فیزیک و اندازه گیری
جزوه جامع فیزیک دهم ریاضی فصل 2 ویژگی های فیزیکی مواد
جزوه جامع فیزیک دهم ریاضی فصل 3 کار، انرژی و توان
جزوه جامع فیزیک دهم ریاضی فصل 4 دما و گرما
جزوه جامع فیزیک دهم ریاضی فصل 5 ترمودینامیک
گرما و دمای تعادل
گرما و دمای تعادل
گرما Q
به انرژی انتقال یافته بر اثر اختلاف دمای دو جسم، گرما گفته می شود.
عبارت گرمایی که جسم دارد، نادرست است. گرما مربوط به انرژی در حال گذار (انرژی انتقال یافته) است.
گرما از جنس انرژی است. بنابراین یکای آن در SI ژول است.
علت انتقال گرما، اختلاف دما است.
دمای جسم A از دمای B بیشتر است؛ پس گرما از A به B منتقل می شود.
هنگام کاهش دمای جسم گرم، میانگین انرژی جنبشی و پتانسیل ذرات آن کاهش و باعث بالا بردن، میانگین انرژی جنبشی و پتانسیل ذرات جسم سرد و در نتیجه افزایش دمای آن می شود تا آنکه دو جسم به تعادل گرمایی برسند.
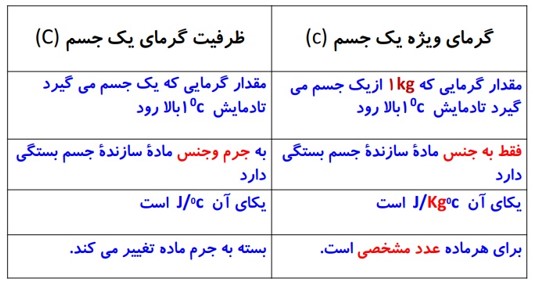
ظرفیت گرمایی
با نماد C (بزرگ) نمایش داده می شود.
مقدار گرمایی است که دمای جسم را \(1{}^0C\) یا \(1K\) افزایش می دهد.
یکای ظرفیت گرمایی \(\frac{J}{K}\) است.
ظرفیت گرمایی اجسام به جنس جسم و جرم آن ها بستگی دارد.
محاسبه گرما با استفاده از ظرفیت گرمایی:
\(Q = C\Delta T\)
(\(Q\)) به معنای گرما و بر حسب ژول
(C) به معنای ظرفیت گرمای جسم و بر حسب ژول بر کلوین
(\(\Delta T\)) به معنای تغییر دما و برحسب کلوین
گرمای ویژه:
با نماد c (کوچک) نمایش داده می شود.
ظرفیت گرمایی واحد جرم اجسام را گرمای ویژه آن جسم می گویند.
\(c = \frac{C}{m}\)
یکای آن \(\frac{J}{{Kg.K}}\) است.
گرمای ویژه یک جسم به جنس ماده تشکیل دهنده آن بستگی دارد.
گرمای ویژه، مقدار گرمایی است که، باید به یک کیلوگرم از هر جسم داده شود تا دمای آن یک درجه سلسیوس (یا یک کلوین) افزایش یابد.
مقایسه گرمای ویژه با ظرفیت گرمایی
فرمول مقدار گرمای لازم برای تغییر دما یک جسم:
\(Q = C\Delta T = mc\Delta T\)
1 رابطه \(Q = mc\Delta \theta \) تا هنگامی برای یک جسم صادق است که، حالت جسم در اثر مبادله گرما تغییر نکند، یعنی جامد تبدیل به مایع نشود، مایع تبدیل به گاز نشود و ... .
2 گرما، کمیتی نرده ای است، اما برای آن علامت مثبت و منفی تعریف می شود.
دمای جسم بعد از مبادله ی گرما:
اگر دما افزایش یابد (\({\theta _2}\rangle {\theta _1}\) ):
بنابراین \(\Delta \theta \rangle 0\) و مقداری که برای Q به دست می آید، مثبت است و جسم گرما گرفته است.
اگر دما کاهش یابد (\({\theta _2}\langle {\theta _1}\) ):
بنابراین \(\Delta \theta \langle 0\) و مقداری که برای Q به دست می آید، منفی است و جسم گرما از دست داده است.
یک مول: n
شامل \(6/02 \times {10^{23}}\) از اجزای سازنده آن ماده (اتم یا مولکول) است.
\(\frac{{1mol}}{n} = \frac{{{N_A} = 6/02 \times {{10}^{23}}}}{N}\)
(n) تعداد مول های یک جسم
(N) تعداد مولکول
(\({{N_A}}\) ) عد آووگادرو
جرم مولی: M
جرم یک مول از هر ماده را جرم مولی می گویند.
تعداد مول ها را نیز می توان از رابطه ی زیر به دست آورد:
\(n = \frac{m}{M}\)
(n) تعداد مول های جسم (mol)
(m) جرم جسم و برحسب Kg
(M) جرم مولکولی و برحسب \(\frac{{Kg}}{{mol}}\)
گرمای ویژه مولی:
مقدار گرمایی است که دمای یک مول از ماده را \(1K\) افزایش می دهد.
گرمای ویژه مولی فلزات همگی یکسان و تقریبا برابر \(25\frac{J}{{mol.K}}\) است.
قاعده دولن و پتی
گرمای لازم برای بالا بردن دمای یک مول از هر فلز برابر است و به جنس آن ها بستگی ندارد.
\(Q = n{c_m}\Delta \theta \to Q \propto n\)
دمای تعادل: \({\theta _e}\)
هرگاه دو یا چند جسم در تماس با یکدیگر قرار گیرند بعد از مبادله انرژی، دمای تمام جسم ها یکسان می شود. به این دما (دمای تعادل) می گوییم.
قانون پایستگی انرژی در تعادل گرمایی:
همان قدر که اجسام گرم انرژی از دست می دهند، اجسام سرد انرژی می گیرند. یعنی جمع جبری این Q ها صفر است:
\(\begin{array}{l}{Q_1} + {Q_2} + ... + {Q_n} = 0\\m{}_1{c_1}\left( {{\theta _e} - {\theta _1}} \right) + {m_2}{c_2}\left( {{\theta _e} - {\theta _2}} \right) + {m_3}{c_3}\left( {{\theta _e} - {\theta _3}} \right) + ... = 0\end{array}\)
(\({{\theta _e}}\)) دمای تعادل (نهایی)
(\({{\theta _2}}\)) دمای اولیه جسم دوم
(\({{\theta _3}}\)) دمای اولیه جسم سوم
شرط تعادل گرمایی:
دمای نهایی جسم های در تماس با هم برابر شوند.
\(Cold\langle {\theta _e}\langle Warm\)
Cold به معنای سرد و Warm به معنای گرم است.
گرما سنج (کالری متر):
ظرفی فلزی و درپوش دار است که به خوبی عایق بندی گرمایی شده است.
مجموعه فلاسک و همزن و دما سنج درون آن را گرما سنج می نامند.
این ظرف در آزمایشگاه برای تعیین گرمای ویژه اجسام به کار می رود.
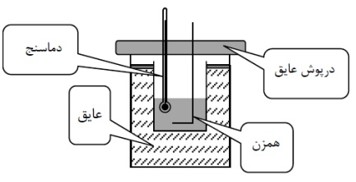
پیدا کردن ظرفیت گرمایی گرماسنج:
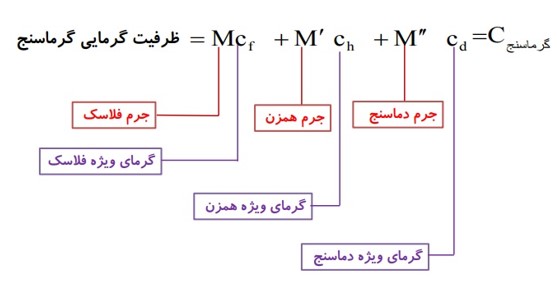
توان گرمایی: P
مقدار گرمایی را که یک گرمکن برقی در هر ثانیه تولید می کند.
\(P = \frac{Q}{{\Delta t}}\)
واحد توان برابر ژول بر ثانیه (\(\frac{J}{s}\)) یا وات است.
از رابطه ی \({Q_1} + {Q_2} + ... + {Q_n} = 0\) می توان رابطه ی زیر را به دست آورد. در این رابطه، \({{\theta _e}}\) دمای تعادل است.
\({\theta _e} = \frac{{m{}_1{c_1}{\theta _1} + {m_2}{c_2}{\theta _2} + {m_3}{c_3}{\theta _3} + ...}}{{m{}_1{c_1} + {m_2}{c_2} + {m_3}{c_3} + ...}}\)
تا زمانی می توان از رابطه دمای تعادل استفاده کرد که در اثر مبادله گرما حالت جسم تغییر نکند. (گرماسنج و ظرفیت گرمایی گرماسنج داخل مسئله نباشد.)
1 اگر تبادل گرمایی بین دو یا چند جسم با دماهای اولیه متفاوت ولی یک جنس انجام شود، دمای تعادل از رابطه زیر بدست می آید:
\(\begin{array}{l}{c_1} = {c_2} = {c_3} = ...\\{\theta _e} = \frac{{m{}_1{\theta _1} + {m_2}{\theta _2} + {m_3}{\theta _3} + ...}}{{m{}_1 + {m_2} + {m_3} + ...}}\end{array}\)
2 اگر تبادل گرمایی بین دو یا چند جسم مشابه و فقط دمای اولیه شان متفاوت است، انجام شود، دمای تعادل از رابطه زیر بدست می آید:
\(\begin{array}{l}{c_1} = {c_2} = {c_3} = ...\\{m_1} = {m_2} = {m_3} = ...\\{\theta _e} = \frac{{{\theta _1} + {\theta _2} + {\theta _3} + ...}}{{1 + 1 + 1 + ...}} = \frac{{{\theta _1} + {\theta _2} + {\theta _3} + ...}}{n}\end{array}\)
یعنی در واقع در این حالت یک عملیات میانگین گیری بین دماهای اولیه باید انجام داد.
حالات ماده و گرمای نهان ذوب
حالات ماده و گرمای نهان ذوب
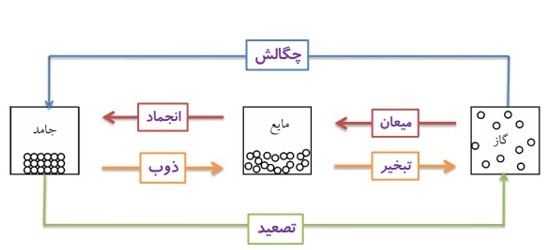
حالت های ماده
ماده به سه حالت جامد، مایع و گاز یافت می شود.
گذار ماده از یک حالت (فاز) به حالت (فاز) دیگر را تغییر حالت (تغییر فاز) می گویند.
تغییر حالت ها معمولا با گرفتن یا از دست دادن گرما همراه اند.
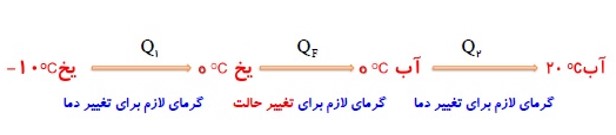
به نمودار زیر توجه کنید:
تصعید
تغییر حالت مستقیم جامد به بخار را تصعید می گویند.
مانند نفتالین و یخ خشک بدون این که به مایع تبدیل شوند مستقیما به بخار تبدیل می شوند، بنابراین می گوییم متصاعد شده اند.
وقتی لباس های تر در زمستان یخ زده اند، به هنگام طلوع خورشید بدون این که یخ ذوب شود به بخار تبدیل می شود.
چگالش
تغییر حالت مستقیم بخار به جامد را چگالش گویند.
تشکیل برف، برفک روی چمن ها و برفک درون یخچال، چگالش است.
اگر آب جوش، به هوا در دمای \( - 40{}^0C\) پاشیده شود، مستقیما به یخ تبدیل می شود.
1 ذوب، تبخیر و تصعید گرماگیر هستند.
2 انجماد، میعان و چگالش گرماده (گرمازا) هستند.
3 هر گاه دمای هوا به زیر نقطه انجماد آب برسد، بخار آب موجود در هوا مستقیما به ذره های جامد برف تبدیل می شوند. از آنجا که عمل چگالش گرمازا است، روز بارش برف، هوا کمی گرم می شود.
ذوب
هر جسم جامدی در دمای ثابتی به نام دمای ذوب (نقطه ی ذوب) که به جنس و فشار وارد بر جسم بستگی دارد، شروع به ذوب شدن می کند.
در تمام مدت ذوب، دمای جسم ثابت می ماند.
1 افزایش فشار، سبب بالا رفتن دمای ذوب می شود؛ در بعضی از جسم ها مانند یخ با افزایش فشار، نقطه ی ذوب، پایین می آید.
2 کاهش فشار، سبب بالا رفتن دمای ذوب یخ می شود.
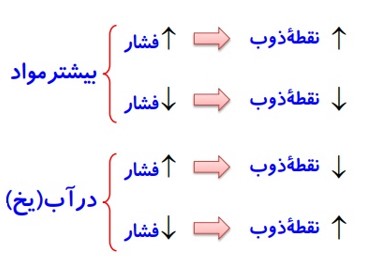
3 افزایش فشار بر روی یخ نقطه ی ذوب یخ را کاهش می دهد زیرا، افزایش فشار باعث می شود که ساختار مولکولی بلور یخ تا حدی از بین برود یعنی فضای خالی پر و آرایش مولکول ها یکنواخت و به هم نزدیک تر شده و به مولکول آب تبدیل شود.

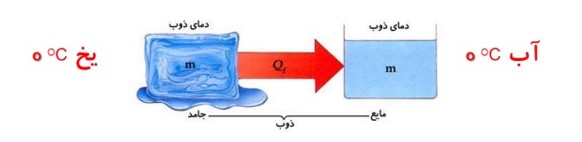
گرمای ذوب: \({Q_F}\)
گرمایی است که هر جسم جامد در نقطه ی ذوب خود می گیرد تا به مایع در همان دما تبدیل شود.
گرمای ذوب جسم به جنس جسم و جرم آن بستگی دارد.
گرمای نهان ذوب: \({L_F}\)
گرمایی است که باید به یک کیلوگرم جسم جامد در دمای ذوب داده شود تا به مایع در همان دما تبدیل شود.
گرمای ذوب واحد جرم اجسام را گرمای نهان ذوب گویند. \({L_F} = \frac{{{Q_F}}}{m}\)
اگر به یخ \(0{}^0C\) گرما دهیم دمای آن افزایش نمی یابد بلکه به آب \(0{}^0C\) تبدیل می شود.
گرمای نهان ذوب اجسام فقط به جنس جسم آنها بستگی دارد.
فرمول گرمای ذوب:
\({Q_F} = m{L_F}\)
(\({Q_F}\) ) گرمای ذوب و برحسب ژول
(m) جرم جسم جامد و بر حسب کیلوگرم
(\({L_F}\) ) گرمای نهان ذوب و برحسب ژول بر کیلوگرم (\(\frac{J}{{Kg}}\) )
مثال
گرمای ذوب 3 کیلوگرم یخ صفر درجه ی سلسیوس چند ژول است؟ (\({L_F} = 334\frac{{KJ}}{{Kg}}\) )
\(\begin{array}{l}{L_F} = 334\frac{{KJ}}{{Kg}}\\m = 3Kg\\{Q_F} = ?\\{Q_F} = m{L_F} \to {Q_F} = 3 \times 334000 = 1002000J = 1002KJ\end{array}\)
هر چه \({L_F}\) بزرگتر باشد ذوب کردن نیاز به گرمای بیشتری دارد.
انجماد
فرآیند انجماد وارون فرآیند ذوب است، یعنی در این فرآیند مایع تبدیل به جامد می شود.
دمای نقطه ذوب با دمای نقطه ی انجماد برابر است، به طور مثال دمای ذوب یخ و دمای انجماد آب هر دو صفر درجه می باشد.
1 هر گاه از مایعی در دمی انجمادش گرما بگیریم، کاهش دما رخ نداده و مایع تبدیل به جامد می شود.
2 مقدار گرمایی که جسم از دست می دهد تا انجماد یابد برابر مقدار گرمایی است که جسم می گیرد تا ذوب شود.
گرمای نهان انجماد: \( - {L_F}\)
گرمای نهان انجماد، منفی گرمای نهان ذوب است.
فرمول گرمای انجماد: \({Q_F}\)
\({Q_F} = - m{L_F}\)
(\({Q_F}\) ) گرمای انجماد و بر حسب ژول
(m) جرم جسم مایع و برحسب کیلوگرم
(\({L_F}\) ) گرمای نهان ذوب و برحسب ژول بر کیلوگرم
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه ریاضی- آزمون آنلاین تمامی دروس پایه ریاضی
- گام به گام تمامی دروس پایه ریاضی
- ویدئو های آموزشی تمامی دروس پایه ریاضی
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه ریاضی
- فلش کارت های آماده دروس پایه ریاضی
- گنجینه ای جامع از انشاء های آماده پایه ریاضی
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه ریاضی
جوش و میعان
جوش و میعان
تبخیر سطحی
بخار شدن مایع ها از سطح آزاد آنها در دمای محیط، را تبخیر سطحی می گوییم.
تا پیش از رسیدن به نقطه جوش مایع، تبخیر به طور پیوسته ای از سطح مایع رخ می دهد.
در تبخیر سطحی گرمای لازم برای تبخیر از مولکول های سطح از محیط پیرامون و در اغلب مواقع از مولکول های زیرین دریافت می کنند.
1 تا زمانی که دمای مایع به نقطه جوش نرسیده حبابی تشکیل نخواهد شد.
2 عمل تبخیر گرماگیر است، مولکول های بخار شده، انرژی گرمایی لازم جهت تبخیر را از مولکول های باقی مانده می گیرند. در نتیجه، انرژی درونی مایع باقی مانده کاهش یافته و دمای آن نیز کاهش می یابد.
شباهت تبخیر سطحی و جوش:
- در هر دو مایع به بخار تبدیل می شود.
- هر دو گرما گیرند.
تفاوت تبخیر سطحی و جوش:
- تبخیر سطحی در هر دمایی صورت می گیرد، ولی جوشیدن مایع در نقطه ی جوش صورت می گیرد.
- در تبخیر سطحی فقط مولکول های سطح مایع به بخار تبدیل می شوند، ولی در جوش مولکول های زیرین مایع نیز بخار شده و از سطح مایع خارج می شوند.
- در تبخیر سطحی با حباب (قل زدن) همراه نیست، ولی در جوش با قل زدن و صدای غلغل همراه است.
آهنگ تبخیر سطحی بنا به شرایط زیر افزایش می یابد:
- افزایش دمای محیط
- افزایش مساحت سطح آزاد مایع
- وزش باد
- کاهش رطوبت
- کاهش فشار هوا
نقطه جوش
هر مایعی در دمای ثابتی به نام دمای جوش که به جنس و فشار وارد بر آن بستگی دارد، به جوش آمده و تبدیل به بخار می شود.
1 افزایش فشار، سبب بالا رفتن دمای جوش آب می شود.
2 کاهش فشار، سبب پایین آمدن نقطه ی جوش آب می شود.
گرمای تبخیر
مقدار گرمایی است که هر مایع در نقطه ی جوش خود می گیرد تا به بخار در همان دما تبدیل شود.
گرمای تبخیر جسم به جنس جسم و جرم آن بستگی دارد.
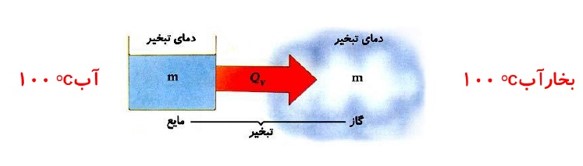
گرمای نهان تبخیر: \({L_V}\)
گرمایی است که به یک کیلو گرم از مایع در نقطه ی جوش می دهیم تا به بخار در همان دما تبدیل شود.
گرمای تبخیر واحد جرم اجسام را گرمای نهان تبخیر می گویند. \({L_V} = \frac{{{Q_V}}}{m}\)
گرمای نهان تبخیر اجسام فقط به جنس آنها بستگی دارد.
فرمول گرمای تبخیر:
\({Q_V} = m{L_V}\)
با افزایش دما جنبش مولکول ها افزایش یافته در نتیجه پیوند بین آنها سست تر می شود و مولکول ها برای جدا شدن از سطح به انرژی کمتری نیاز دارد.
میعان
فرآیند میعان وارون فرآیند تبخیر است یعنی در این فرآیند بخار به مایع در همان دما تبدیل می شود.
دمای نقطه ی میعان یک ماده با دمای نقطه ی جوش آن برابر است، به طور مثال دمای نقطه ی میعان آب \(100{}^0C\) است.
هر بخار هنگام میعان همان قدر گرما از دست می دهد که به هنگام تبخیر می گیرد.
گرمای نهان میعان منفی گرمای نهان تبخیر است.
فرمول گرمای میعان: \({Q_V}\)
\({Q_V} = - m{L_V}\)
(m) جرم گاز است.
مثال
گرمکنی در هر ثانیه \(200j\) انرژی فراهم می کند. چه مدت طول می کشد تا این گرمکن \(0/1Kg\) آب \(100{}^0C\) را به بخار \(100{}^0C\) تبدیل کند؟ (\({L_V} = 2256\frac{{KJ}}{{Kg}}\) )
\(\begin{array}{l}P = 200w\\t = ?\\m = 0/1Kg\\{L_F} = ?\\Q = pt\\{Q_V} = mL{}_V\\ \to pt = mL{}_V \to t = \frac{{mL{}_V}}{p} = \frac{{0/1 \times 2256 \times {{10}^3}}}{{200}} \to t = 1128s\end{array}\)
جزوات جامع پایه ریاضی
جزوه جامع فیزیک دهم ریاضی فصل 1 فیزیک و اندازه گیری
جزوه جامع فیزیک دهم ریاضی فصل 2 ویژگی های فیزیکی مواد
جزوه جامع فیزیک دهم ریاضی فصل 3 کار، انرژی و توان
جزوه جامع فیزیک دهم ریاضی فصل 4 دما و گرما
جزوه جامع فیزیک دهم ریاضی فصل 5 ترمودینامیک
روش های انتقال گرما
روش های انتقال گرما
انتقال گرما
اختلاف دما باعث شارش گرما از جسم با دمای بالاتر به جسم با دمای پایین تر می شود. این شارش گرما به سه صورت انجام می شود:
1) رسانش

2) همرفتی
3) تابش
رسانش گرمایی در فلزات بیشتر از غیر فلزات است زیرا، در غیر فلزات گرما فقط از طریق ارتعاش اتم ها انتقال می یابد.
اما در فلزات، افزون بر ارتعاش اتم ها، الکترون های آزاد (درون فلز) هم در انتقال گرما نقش دارند. در واقع این الکترون های آزاد که نسبت به اتم ها بسیار کوچک هستند، در اثر دریافت گرما، سرعت گرفته و به سایر الکترون ها و اتم ها برخورد می کنند و به این ترتیب رسانندگی گرمایی فلزات را افزایش می دهند.
روش های انتقال گرما
الف) رسانش گرمایی:
در این روش به دلیل ارتعاش اتم ها و حرکت الکترون های آزاد در قسمت های گرم تر و گسترش این حرکت و ارتعاشات به سراسر جسم، گرما منتقل می شود، مانند انتقال گرما در فلزات
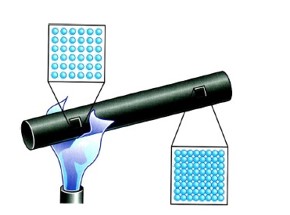
یکای رسانندگی گرمایی در SI طبق زیر است:
\(K = \frac{{J.m}}{{{m^2}.s.K}} = \frac{J}{{m.s.K}} = \frac{W}{{m.K}}\)
در پدیده ی رسانش:
گرما از یک بخش جسم به بخش دیگر آن شارش می کند، بدون آنکه مولکول های جسم جا به جا شوند.
به جسم هایی که می توانند گرما را (در زمان کوتاهی) به این روش منتقل کنند، رسانای گرما گفته می شود.
پدیده ی همرفت:
انتقال گرما همراه با انتقال ماده را همرفت می گویند. که مختص مایعات و گازها است.
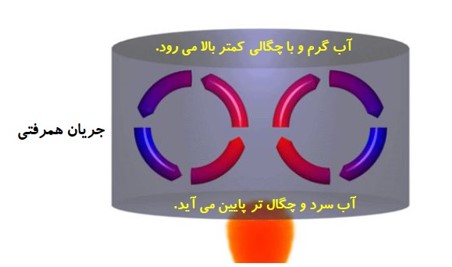
انواع جریان همرفتی
همرفت طبیعی
در این روش، به دلیل اختلاف چگالی شاره گرم و سرد به صورت خود به خود اتفاق می افتد. شاره با چگالی کمتر به طرف بالا حرکت می کند.
مانند گرم شدن آب درون قابلمه و هوای داخل اتاق و جریان های باد ساحلی و ... .
همرفت واداشته
شاره به کمک یک تلمبه (مصنوعی) به حرکت واداشته می شود تا با این حرکت انتقال گرما انجام شود.
سیستم گرم کننده ساختمان ها (شوفاژ)، سیستم خنک کننده موتور اتومبیل، دستگاه گردش خون در بدن جانوران خونگرم و ... .
همرفت طبیعی هوا
در شرایط عادی هوای اطراف سطح زمین گرم و هوای لایه های بالاتر سرد است. در این شرایط در اثر پدیده همرفت هوای گرم با چگالی کمتر به بالا رفته و هوای سرد تر با چگالی بیشتر جای آن را می گیرد و بدین ترتیب چرخش هوا در سطح زمین ایجاد می شود.
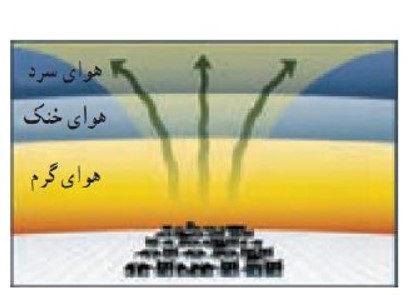
وارونگی هوا (وارونگی دما)
در روز های سرد زمستانی هوای اطراف سطح زمین سرد و چگالی آن زیاد و هوای لایه های بالاتر، گرم تر و چگالی آنها کمتر است. تحت این شرایط همرفت طبیعی هوا متوقف می شود که به آن وارونگی هوا می گویند.
وارونگی دما باعث انباشت آلاینده های موجود در لایه هوای سرد سطح زمین و در نتیجه آلودگی هوا در شهر های صنعتی می شود.
تابش گرمایی:
به انتقال گرما از طریق امواج الکترومغناطیسی که از اجسام منتشر می شود، تابش گرمایی می گویند.
1 اجسام در هر دمایی تابش الکترومغناطیسی گسیل می کنند.
2 در تابش گرمایی، انرژی برای انتقال نیازی به محیط مادی ندارد و گرمای تابش شده بسیار سریع (با سرعت نور) در خلاء نیز منتشر می شود.
3 در دماهای زیر حدود پانصد سانتی گراد عمدتا به صورت تابش فروسرخ است که نامرئی است.
4 بخشی از تابش گرمایی منتشر شده از اجسام، تابش نامرئی فروسرخ است که برای آشکار سازی آن از ابزاری به نام دمانگار استفاده می شود.
تابش گرمایی از سطح هر جسم به عوامل زیر بستگی دارد:
- دما: هرچه دمای جسم بیشتر باشد، آهنگ تابش آن نیز بیشتر است.
- مساحت: هرچه مساحت جسم بیشتر باشد، میزان تابش آن نیز بیشتر است.
- رنگ: هر قدر رنگ جسم مات و تیره تر و سطحش ناصاف تر باشد، جذب و تابش بهتری دارد.
- میزان صیقلی بودن: جسم هایی که سطح صیقلی و درخشان تری دارند، تابش کمتری دارند و بخش کمتری از گرمای دریافتی را جذب می کنند.
تف سنج
تف سنج وسیله ای برای اندازه گیری دما برای اجسام داغ است. اساس کار این وسیله، تابش گرمایی گسیل شده از سطح جسم است.
انواع تف سنج و ویژگی های مهم تف سنج:
تف سنج تابشی و تف سنج نوری
1) بدون تماس با جسم دمای آن را اندازه گیری می کند.
2) برای اندازه گیری دماهای بالای \(1100{}^0C\) بسیار مناسب اند.
اساس کار تف سنج نوری:
مقایسه رنگ و شدت نور تابیده از کوره با رنگ و شدت نور یک لامپ رشته ای است. همچنین این دماسنج به عنوان دماسنج معیار برای اندازه گیری این دماها انتخاب شده است.
از کاربرد های تابش گرمایی در پدیده های زیستی می توان به مار زنگی و کلم اسکانک اشاره کرد.
قانون گاز ها
قانون گاز ها
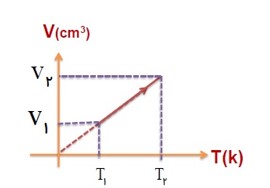
برسی گاز در فشار ثابت (قانون شارل):
در فشار ثابت، حجم گاز با دمای آن در مقیاس کلوین نسبت مستقیم دارد.
در فشار ثابت، نسبت حجم به دمای مطلق مقداری گاز کامل، مقداری ثابت است.
(فشار و جرم ثابت):
\(V \propto T \to \frac{V}{T} \to \frac{{{V_1}}}{{{T_1}}} = \frac{{{V_2}}}{{{T_2}}} = ...\)
برسی گاز در حجم ثابت (قانون گی لوساک):
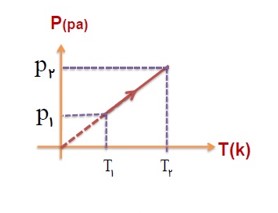
در حجم ثابت، فشار گاز با دمای آن در مقیاس کلوین نسبت مستقیم دارد.
(حجم و جرم ثابت):
\(P \propto T \to \frac{P}{T} \to \frac{{{P_1}}}{{{T_1}}} = \frac{{{P_2}}}{{{T_2}}} = ...\)
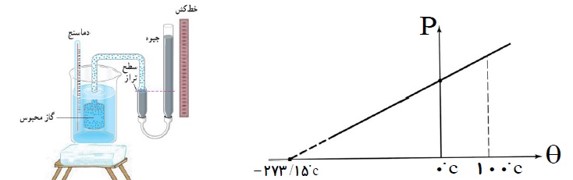
دماسنج گازی حجم ثابت:
اساس کار یک دماسنج گازی، تغیرات فشار با دما، در حجم ثابت است. در این دماسنج مقداری گاز (معمولا هیدروژن یا هلیم است) درون یک مخزن با حجم معین قرار می گیرد که این مخزن به لوله U شکلی که محتوی جیوه متصل است. وقتی مطابق شکل مخزن محتوی گاز در محیط مورد اندازه گیری قرار می گیرد، گاز درون آن منبسط یا منقبض می شود. حال با بالا یا پایین بردن بخش سمت راست لوله U شکل، سطح جیوه را در سمت چپ در یک سطح مرجع معین ثابت نگه می داریم، تا حجم گاز ثابت بماند. اگر لوله سمت راست روی یک خط کش مدرج قرار داده شود، می توان با یادداشت کردن مقادیر فشار در دماهای مختلف، نمودار P-T آن را رسم کنیم.
اگر این خط راست به کمک برون یابی در فشار های پایین تر ادامه می دهیم، در دمای \( - 273/15{}^0C\) محور دما را قطع خواهد کرد.
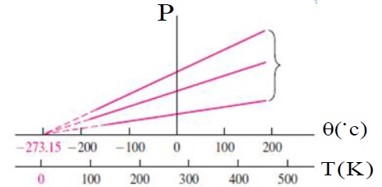
نمودار فشار بر حسب دما در حجم ثابت:
در واقع هیچ گازی (از هیدروژن و هلیم که در این دما سنج به کار می روند) تا این دما سرد نمی شود، زیرا قبل از رسیدن به این دما همه گاز ها مایع می شوند. برای انواع متفاوت گاز ها می تان این نمودار را به دست آورد، که در همه موارد، نقطه برخورد با محور دما همان \( - 273/15{}^0C\) خواهد بود که این همان صفر مطلق است. با یک تغییر مقیاس از درجه سلسیوس به کلوین دماهای منفی نیز حذف خواهند شد و از رابطه \(\frac{{{P_1}}}{{{T_1}}} = \frac{{{P_2}}}{{{T_2}}}\) نیز فشار منفی به دست نخواهد آمد.
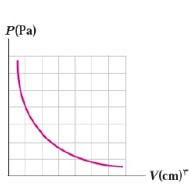
برسی گاز در دمای ثابت (قانون بویل و ماریوت):
در دمای ثابت، حجم مقدار معینی از گاز با فشار آن نسبت وارون دارد.
برای یک گاز کامل در دمای ثابت، حاصل ضرب حجم در فشار آن مقداری ثابت است.
\(T = T \to V \propto \frac{1}{P} \to {P_1}{V_1} = {P_2}{V_2} = ...\)
قانون آووگادرو
در دما و فشار یکسان، نسب حجم گاز V به تعداد مولکول های آن N ثابت است.
جرم گاز و یا به طور معادل n تعداد مول گاز است.
(دما و فشار یکسان)
\(\frac{V}{N} = \) فشار ثابت
\(n = \frac{N}{{{N_A}}}\)
\(\frac{V}{n} = \) مقدار ثابت
قانون گاز های آرمانی کامل:
- هنگامی که گاز ها بسیار رقیق یا چگالی آن به حد کافی کم باشد.
- گازی که مولکول های آن ها به حدی از هم دورند که برهم تاثیر چندانی نمی گذارند.
در گاز های کامل، معادله ی حالت آن ها ساده و مستقل از نوع گاز است. در این حالت گاز کامل نامیده می شوند.
از ترکیب چهار قانون فوق رابطه زیر حاصل می شود.
\(\frac{{PV}}{{nT}} = \) فشار ثابت \( \to PV = nRT\)
فرمول گاز های کامل
\(PV = nRT\)
در این فرمول
(P) فشار گاز و بر حسب (pa)
(V) حجم گاز و بر حسب (\({m^3}\) )
(n) تعداد مول های گاز و بر حسب مول
(R) ثابت گاز و بر حسب (\(\frac{J}{{mol.K}}\) )
(T) دمای گاز و بر حسب (K)
در صورتی که با تغییر شرایط یک گاز، مقدار آن تغییر نکند. \({n_1} = {n_2}\)
\(\begin{array}{l}PV = nRT \to n = \frac{{PV}}{{RT}} \to {n_1} = {n_2} \to \frac{{{P_1}{V_1}}}{{{T_1}R}} = \frac{{{P_2}{V_2}}}{{{T_2}R}}\\ \to \frac{{{P_1}{V_1}}}{{{T_1}}} = \frac{{{P_2}{V_2}}}{{{T_2}}}\end{array}\)
در استفاده از رابطه ی بالا فشار و حجم باید در در دو طرف تساوی هم واحد باشند اما باید دما تنها بر حسب کلوین باشد.
رابطه گاز کامل، در فرم مقایسه ای آن (برای دو گاز مختلف) به شکل زیر نوشته می شود:
\(\frac{{PV}}{{nT}} = R \to \frac{{{P_1}{V_1}}}{{{n_1}{T_1}}} = \frac{{{P_2}{V_2}}}{{{n_2}{T_2}}}\)
در نوشتن روابط نسبی فوق فشار و حجم هر واحدی می توانند باشند ولی برای نوشتن نسبت، دما باید بر حسب کلوین باشند.
رابطه چگالی گاز های کامل
به طور کلی چگالی یک گاز کامل با فشار آن نسبت مستقیم و با دمای مطلق آن نسبت عکس دارد.
\(\begin{array}{l}\rho = \frac{m}{v} \to \frac{{{\rho _2}}}{{{\rho _1}}} = \frac{{{v_1}}}{{{v_2}}}\\\frac{{{P_1}{V_1}}}{{{T_1}}} = \frac{{{P_2}{V_2}}}{{{T_2}}} \to \frac{{{V_1}}}{{{V_2}}} = \frac{{{P_2}{T_1}}}{{{P_1}{T_2}}}\\ \to \frac{{{\rho _2}}}{{{\rho _1}}} = \frac{{{P_2}}}{{{P_1}}} \times \frac{{{T_1}}}{{{T_2}}}\end{array}\)
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه ریاضی- آزمون آنلاین تمامی دروس پایه ریاضی
- گام به گام تمامی دروس پایه ریاضی
- ویدئو های آموزشی تمامی دروس پایه ریاضی
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه ریاضی
- فلش کارت های آماده دروس پایه ریاضی
- گنجینه ای جامع از انشاء های آماده پایه ریاضی
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه ریاضی



1736019749.png)















