چرا اپلیکیشن مای درس را نصب کنیم؟
مای درس (My Dars)، فراتر از یک اپلیکیشن درسی ساده است؛ این یک دستیار هوشمند و جامع برای دانشآموزان ابتدایی، متوسطه اول و دوم (تمامی پایهها) است. اگر به دنبال گام به گام رایگان، نمونه سوالات امتحانی تضمینی و ابزارهای کاربردی هستید، جای درستی آمدهاید.
۱. گنجینه آموزشی (رایگان و جامع)
دیگر نگران حل تمرینها و یادگیری دروس نباشید. مای درس شامل:
- گام به گام رایگان تمامی دروس: دسترسی سریع به پاسخ تشریحی تمام فعالیتها و تمرینهای کتاب درسی.
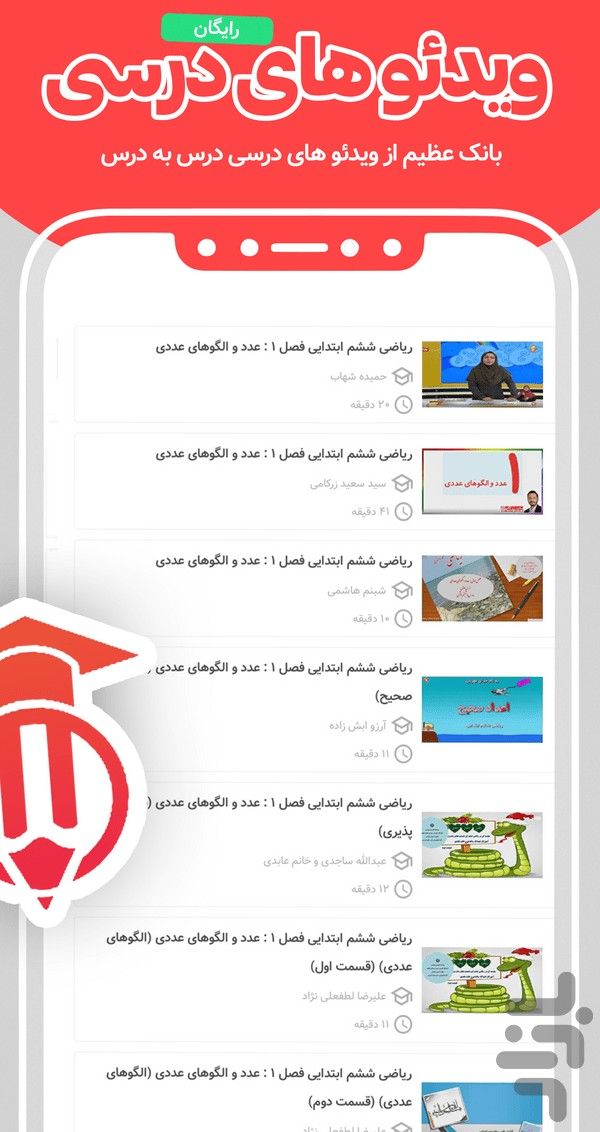
- ویدئوهای آموزشی فصل به فصل: تدریس مباحث دشوار توسط اساتید برتر (دستهبندی شده و رایگان).
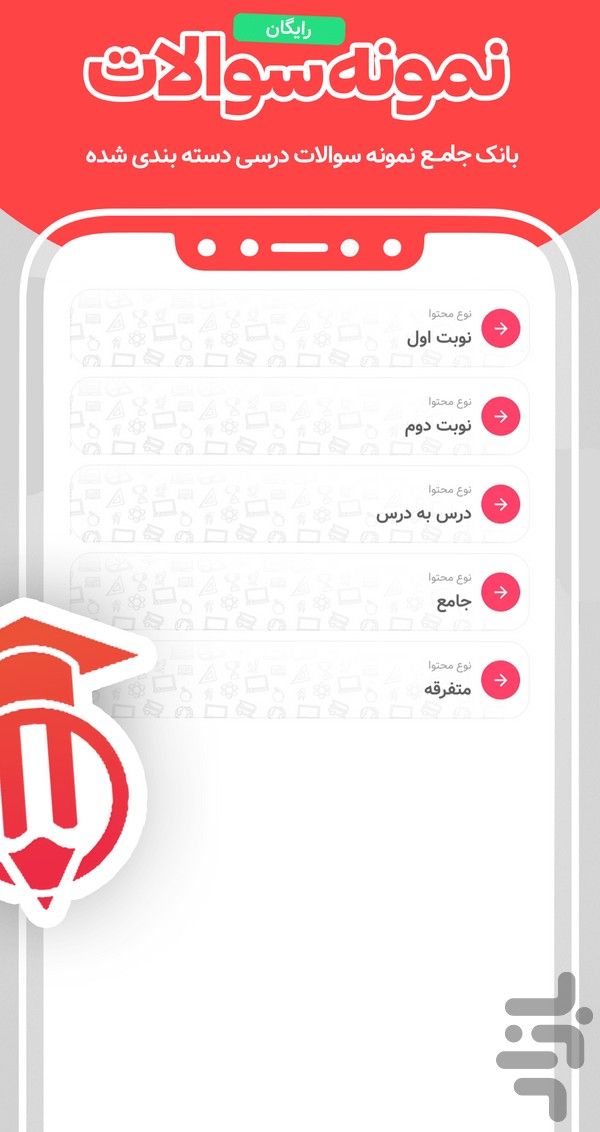
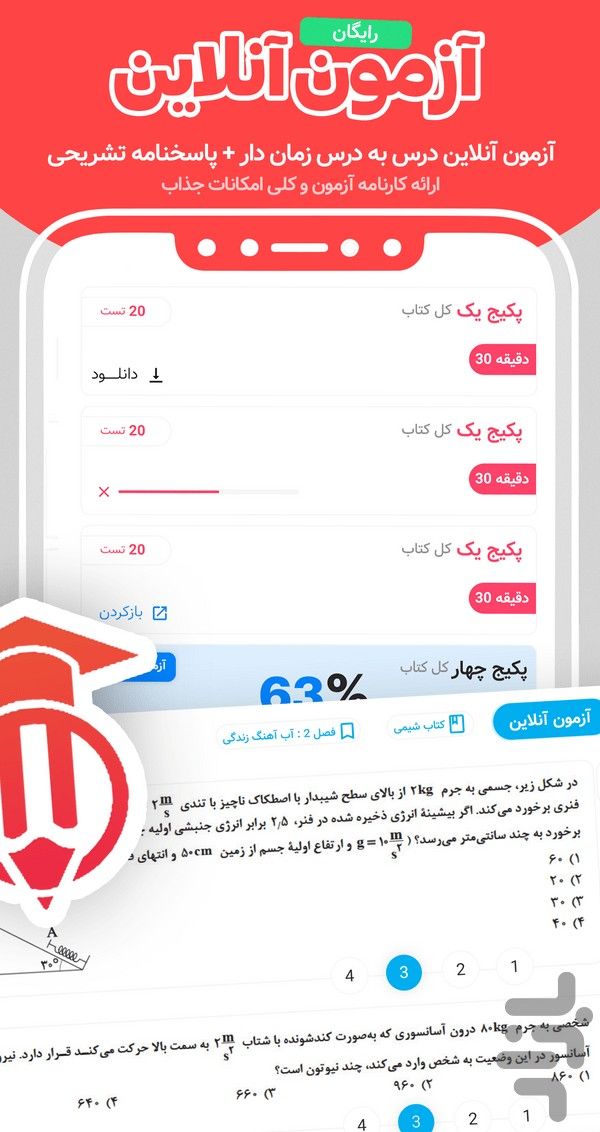
- جزوات و نمونه سوالات امتحانی: هزاران نمونه سوال نوبت اول، دوم و درسبهدرس برای آمادگی شب امتحان.
- شاه کلید نکات و سوالات: مرور سریع مهمترین نکات امتحانی و سوالات پرتکرار هر درس به صورت طبقهبندی شده.
- آموزشهای تخصصی ادبیات و زبان: بخش ویژه شامل آموزش آرایههای ادبی، دستور زبان، قواعد عربی و گرامر انگلیسی به صورت تعاملی.
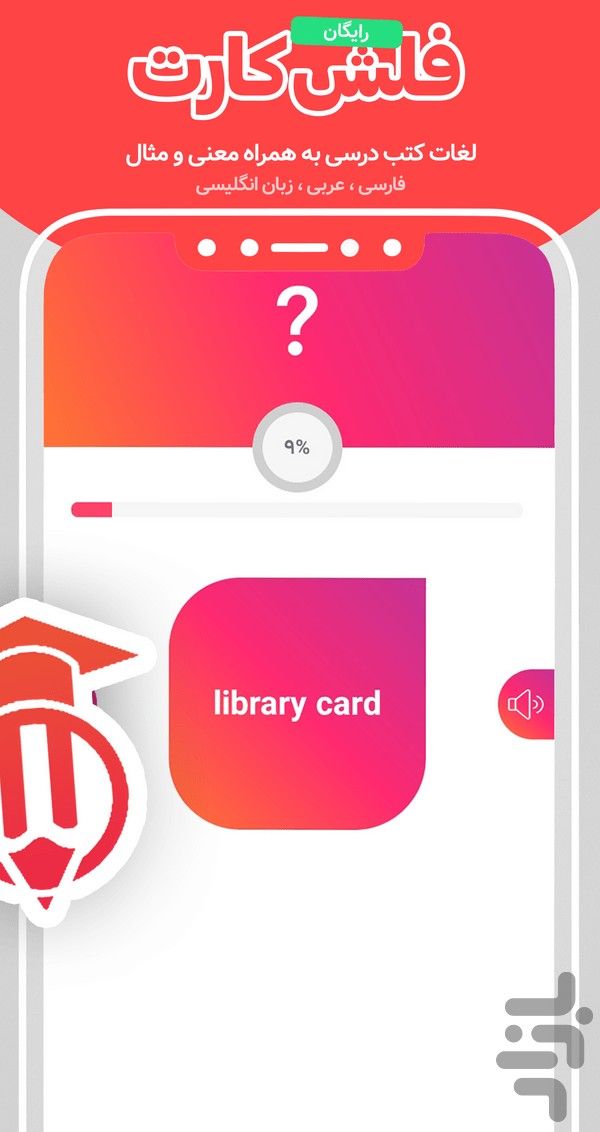
- آزمون آنلاین و فلشکارت: خودآزمایی با تستهای درسبهدرس و مرور لغات مهم عربی، فارسی و انگلیسی با فلشکارتهای هوشمند.
- انشاء من (شبکه اجتماعی دانشآموزی): فضایی برای اشتراکگذاری انشا، مطالعه انشای دیگران و تبادل نظر با دوستان.
- بانک سوال هوشمند (ویژه متوسطه دوم): دسترسی به بیش از ۲۰,۰۰۰ سوال تستی و تشریحی با تحلیل ۴ مرحلهای (پاسخ کوتاه، حل تشریحی، نکته تکمیلی و سوال مشابه) برای تسلط ۱۰۰ درصدی روی مباحث.
۲. جعبه ابزار هوشمند دانشآموز
مای درس فقط محتوا نیست؛ تمام ابزارهای مورد نیازتان را یکجا جمع کردهایم:
- ✅ محاسبه معدل دقیق
- ✅ جدول تناوبی مندلیف
- ✅ ماشین حساب مهندسی
- ✅ محاسبه درصد تست
- ✅ جعبه لایتنر (مرور هوشمند)
- ✅ برنامهریزی هفتگی درسی
- ✅ مبدل واحد و ابزارهای هندسی
۳. زنگ تفریح و سرگرمی
خستگی مطالعه را با ۱۳ بازی فکری و ریاضی جذاب از تن به در کنید و هوش خود را تقویت نمایید.
✨ پیشنهاد ویژه:
با نصب مای درس، یک دستیار هوشمند درسی را همیشه در جیب خود داشته باشید. دسترسی به تمام گامبهگامها و بخشهای اصلی کاملاً رایگان است!



1736019749.png)