جواب فصل 2 آسایش و رفاه در سایه شیمی شیمی دوازدهم
تعداد بازدید : 3.13Mپاسخ به تمامی سوالات فصل آسایش و رفاه در سایه شیمی - حل المسائل فصل 2 آسایش و رفاه در سایه شیمی - گام به گام 1401 کتاب شیمی دوازدهم - گام به گام کتاب شیمی دوازدهم مطابق با آخرین تغییرات کتب درسی
با هم بیندیشیم صفحه 40 درس آسایش و رفاه در سایه شیمی شیمی دوازدهم
پاسخ با هم بیندیشیم صفحه 40 درس 2
جواب با هم بیندیشیم صفحه 40 درس 2 شیمی دوازدهم
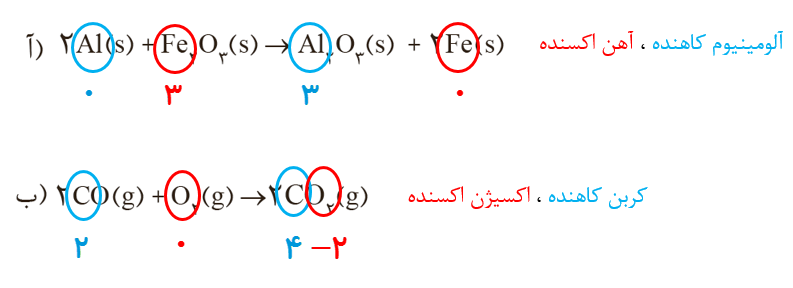
اکسیژن نافلزی فعال است که با اغلب فلزها واکنش می دهد و آنها را به اکسید فلز تبدیل می کند، درحالی که با برخی فلزها مانند طلا و پلاتین واکنش نمی دهد. شکل زیر الگوی ساده ای از واکنش بین اتم های روی و اکسیژن را با ساختار لایه ای اتم نشان می دهد.
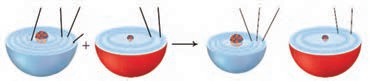
آ) کدام ساختار اتم روی و کدام یک اتم اکسیژن را نشان می دهد؟
ب) کدام اتم الکترون از دست داده و کدام الکترون گرفته است؟
پ) اگر گرفتن الکترون را کاهش و از دست دادن الکترون را اکسایش بنامیم، کدام گونه کاهش و کدام اکسایش یافته است؟
ت) شیمی دان ها هریک از فرایندهای گرفتن و از دست دادن الکترون را با یک نیمواکنش نمایش می دهند که هر نیم واکنش باید از لحاظ جرم (اتم ها) و بار الکتریکی موازنه باشد. اینک با قرار دادن تعداد معینی الکترون، هریک از نیم واکنش های زیر را موازنه کنید
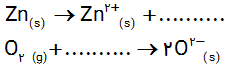
ث) کدام یک از نیم واکنش های بالا، نیم واکنش اکسایش و کدام یک نیم واکنش کاهش را نشان می دهد؟چرا؟
ج) ماده ای که با گرفتن الکترون سبب اکسایش گونه دیگر می شود، اکسنده که با دادن الکترون سبب کاهش گونه دیگر می شود، کاهنده نام دارد. در واکنش روی با اکسیژن، گونه اکسنده و کاهنده را مشخص کنید
آ) از سمت چپ نخستین ساختار مربوط به اتم روی و دومین ساختار مربوط به اتم اکسیژن است .
ب) اتم روی الکترون از دست داده و اتم اکسیژن الکترون گرفته است .
پ) اتم روی ، اکسایش و اتم اکسیژن ، کاهش یافته است .
ت)
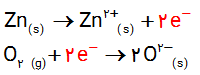
ث) نیم واکنش نخست اکسایش است زیرا در آن اتم های روی الکترون از دست داده اند ( نیم واکنش تولید الکترون ) و نیم واکنش دوم ، کاهش است زیرا در آن اتم های اکسیژن الکترون گرفته اند . ( نیم واکنش مصرف الکترون ).
ت) روی گونه کاهنده و اکسیژن گونه اکسنده است .
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه دوازدهم- آزمون آنلاین تمامی دروس پایه دوازدهم
- گام به گام تمامی دروس پایه دوازدهم
- ویدئو های آموزشی تمامی دروس پایه دوازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دوازدهم
- فلش کارت های آماده دروس پایه دوازدهم
- گنجینه ای جامع از انشاء های آماده پایه دوازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دوازدهم
خود را بیازمایید صفحه 42 درس آسایش و رفاه در سایه شیمی شیمی دوازدهم
پاسخ خود را بیازمایید صفحه 42 درس 2
جواب خود را بیازمایید صفحه 42 درس 2 شیمی دوازدهم
1-اغلب فلزها در واکنش با محلول اسیدها، گاز هیدروژن و نمک تولید می کنند. با توجه به شکل روبه رو که نمایی از این واکنش را نشان می دهد، به پرسش ها پاسخ دهید.
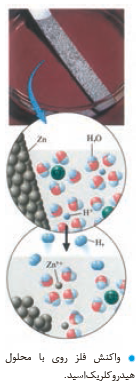
آ) کدام گونه اکسایش و کدام گونه کاهش یافته است؟ چرا؟
ب) نیم واکنش های اکسایش و کاهش را بنویسید و موازنه کنید.
پ) نیم واکنش ها را با هم جمع کنید تا با حذف الکترون ها، معادله واکنش به دست آید.
ت) با خط زدن واژه نادرست در هر مورد، عبارت داده شده را کامل کنید

2- در هریک از واکنش های زیر، گونه های اکسنده و کاهنده را مشخص کنید
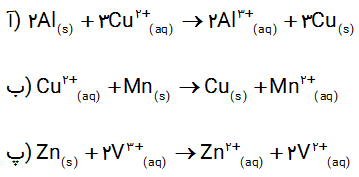
1- آ) روی اکسایش یافته؛ زیرا اتم روی الکترون از دست داده و به کاتیون تبدیل شده است.هیدروژن کاهش یافته؛ زیرا کاتیون هیدروژن الکترون گرفته و به اتم هیدروژن تبدیل شده که این اتم ها به شکل مولکول های دو اتمی از فاز محلول جدا شده اند.
ب)
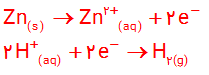
پ)

ت)

2-
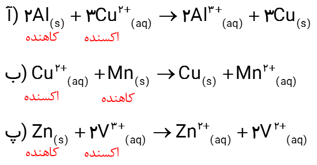
گام به گام کتاب های پایه دوازدهم
گام به گام جامع کتاب شیمی دوازدهم
گام به گام جامع کتاب فارسی دوازدهم
گام به گام جامع کتاب نگارش دوازدهم
گام به گام جامع کتاب عربی دوازدهم
گام به گام جامع کتاب زبان انگلیسی دوازدهم
گام به گام جامع کتاب کتاب کار انگلیسی دوازدهم
گام به گام جامع کتاب دین و زندگی دوازدهم
گام به گام جامع کتاب هویت اجتماعی
گام به گام جامع کتاب سلامت و بهداشت
گام به گام جامع کتاب مدیریت خانواده و سبک زندگی (پسران)
خود را بیازمایید صفحه 43 درس آسایش و رفاه در سایه شیمی شیمی دوازدهم
پاسخ خود را بیازمایید صفحه 43 درس 2
جواب خود را بیازمایید صفحه 43 درس 2 شیمی دوازدهم
جدول زیر داده هایی را از قرار دادن برخی تیغه های فلزی درون محلول مس (II) سولفات در دمای 20°C نشان می دهد. با توجه به آن به پرسش ها پاسخ دهید.
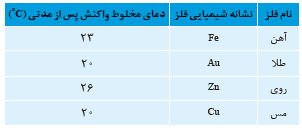
آ ) تغییر دمای مخلوط واکنش نشان دهنده چیست؟
ب) هر یک از واکنش های زیر راکامل کرده سپس گونه های کاهنده و اکسنده را مشخص کنید.

پ) با توجه به تغییر دمای هر سامانه ،کدام فلز تمایل بیشتری به از دست دادن الکترون دارد؟چرا؟
ت) فلزهای Zn , Fe , Au و Cu را بر اساس قدرت کاهندگی مرتب کنید.
ث) پیش بینی کنید هرگاه تیغه مس درون محلول روی سولفات قرار گیرد، آیا واکنشی انجام می شود؟ چرا؟
آ) نشانه انجام واکنش شیمیایی است . چون دمای مخلوط واکنش افزایش یافته پس یک واکنش گرماده رخ داده است .
ب)
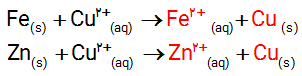
پ) فلز Zn؛ هرچه افزایش دمای مخلوط بیشتر باشد نشان دهنده واکنش پذیری بیشتر واکنش دهنده هاست .
ت) با توجه به داده های جدول ، واکنش پذیری روی بیشتر از آهن و آهن نیز بیشتر از مس است. طلا دارای کم ترین واکنش پذیری در میان چهار فلز است .
ث) خیر؛ قدرت کاهندگی مس از روی کمتر است؛ بنابراین نمی تواند یون های روی را به اتم روی کاهش دهد.
با هم بیندیشیم صفحه 45 درس آسایش و رفاه در سایه شیمی شیمی دوازدهم
پاسخ با هم بیندیشیم صفحه 45 درس 2
جواب با هم بیندیشیم صفحه 45 درس 2 شیمی دوازدهم
شکل زیر نمای ذره ای از سلول گالوانی روی ــ مس (Zn_Cu) را نشان می دهد. با توجه به آن به پرسش ها پاسخ دهید.
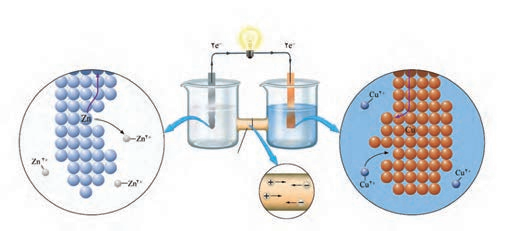
آ) نیم واکنش های انجام شده در هر نیم سلول و واکنش کلی سلول را بنویسید.
ب) آند الکترودی است که در آن نیم واکنش اکسایش و کاتد الکترودی است که در آن نیم واکنش کاهش رخ می دهد. با این توصیف، کدام الکترود نقش آند و کدام نقش کاتد را دارد؟
پ) در مدار بیرونی، حرکت الکترون ها در چه جهتی است؟ چرا؟
ت) توضیح دهید چرا پس از مدتی جرم تیغه روی کم و جرم تیغه مس زیاد شده است؟
آ)
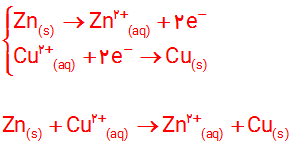
ب) روی الکترود آند و مس الکترود کاتد است .
پ) حرکت الکترون ها در مدار بیرونی از نیم سلول روی به سوی نیم سلول مس است . زیرا فلز روی با واکنش پذیری بیشتر نسبت به فلز مس ، الکترون از دست می دهد و باعث شارش الکترون ها در مدار بیرونی می شود .
ت) با گذشت زمان و انجام نیم واکنش اکسایش در آند ، اتم های بیشتری از تیغه ( الکترود ) روی اکسایش یافته . در حالی که همزمان با آن با انجام نیم واکنش کاهش در کاتد ، کاتیون بیشتری کاهش یافته و به شکل اتم های مس بر سطح تیغه ( الکترود ) مس می نشیند .
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه دوازدهم- آزمون آنلاین تمامی دروس پایه دوازدهم
- گام به گام تمامی دروس پایه دوازدهم
- ویدئو های آموزشی تمامی دروس پایه دوازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دوازدهم
- فلش کارت های آماده دروس پایه دوازدهم
- گنجینه ای جامع از انشاء های آماده پایه دوازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دوازدهم
خود را بیازمایید صفحه 46 درس آسایش و رفاه در سایه شیمی شیمی دوازدهم
پاسخ خود را بیازمایید صفحه 46 درس 2
جواب خود را بیازمایید صفحه 46 درس 2 شیمی دوازدهم
شکل زیر سلول گالوانی مس ــ نقره (Cu_Ag) را نشان می دهد. با توجه به آن به پرسش ها پاسخ دهید.
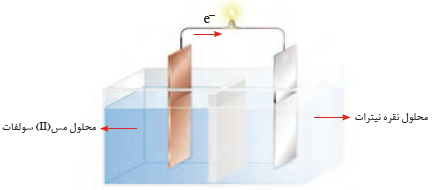
آ) علامت الکترودهای مس و نقره را مشخص کنید
ب) نیم واکنش های انجام شده در آند و کاتد را بنویسید
پ) با انجام واکنش، جرم الکترودها چه تغییری می کند؟ توضیح دهید.
ت) جهت حرکت یون ها را از دیواره متخلخل مشخص کنید
آ) الکترود مس علامت منفی و الکترود نقره علامت مثبت خواهد داشت .
ب)
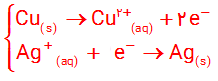
پ) با انجام واکنش از جرم تیغه (الکترود) مس کاسته و بر جرم تیغه (الکترود) نقره افزوده می شود .
ت) آنیون ها از نیم سلول نقره به سوی نیم سلول مس مهاجرت می کنند .
گام به گام کتاب های پایه دوازدهم
گام به گام جامع کتاب شیمی دوازدهم
گام به گام جامع کتاب فارسی دوازدهم
گام به گام جامع کتاب نگارش دوازدهم
گام به گام جامع کتاب عربی دوازدهم
گام به گام جامع کتاب زبان انگلیسی دوازدهم
گام به گام جامع کتاب کتاب کار انگلیسی دوازدهم
گام به گام جامع کتاب دین و زندگی دوازدهم
گام به گام جامع کتاب هویت اجتماعی
گام به گام جامع کتاب سلامت و بهداشت
گام به گام جامع کتاب مدیریت خانواده و سبک زندگی (پسران)
خود را بیازمایید صفحه 48 درس آسایش و رفاه در سایه شیمی شیمی دوازدهم
پاسخ خود را بیازمایید صفحه 48 درس 2
جواب خود را بیازمایید صفحه 48 درس 2 شیمی دوازدهم
با استفاده از جدول 1 مشخص كنید در سلول گالوانی ساخته شده از نقره و منیزیم :
آ) کدام الکترود آند و کدام کاتد خواهد بود؟ چرا؟
ب) نیم واکنش های انجام شده را بنویسید و واکنش کلی سلول را به دست آورید
آ) نقره به عنوان کاتد و منیزیم به عنوان آند خواهد بود؛ زیرا با توجه به اینکه E0 منیزیم کمتر از نقره است، بنابراین منیزیم کاهنده تر بوده پس در جایگاه آند سلول قرار می گیرد و نقره کاتد خواهد بود.
ب)
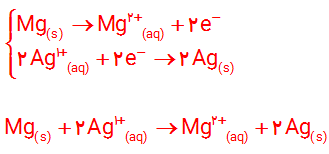
پیوند با ریاضی صفحه 48 درس آسایش و رفاه در سایه شیمی شیمی دوازدهم
پاسخ پیوند با ریاضی صفحه 48 درس 2
جواب پیوند با ریاضی صفحه 48 درس 2 شیمی دوازدهم
1- با مراجعه به جدول 1، هریك از جاهای خالی را پر كنید.

2- در سلول گالوانی تشکیل شده از دو نیم سلول بالا مشخص کنید کدام یک نقش آند و کدام یک نقش کاتد را دارد؟
3- شكل زیر سلول گالوانی استاندارد روی مس را نشان می دهد. با توجه به آن به پرسش های زیر پاسخ دهید:

آ) emf این سلول را از روی شکل مشخص کنید.
ب) كدام رابطۀ زیر برای محاسبه این كمیت به کار رفته است؟ توضیح دهید.

4- در نمودار زیر هر خط رنگی نشان دهنده یك سلول گالوانی تشكیل شده از دو فلز را نشان می دهد. با توجه به جدول پتانسیل استاندارد به پرسش ها پاسخ دهید.
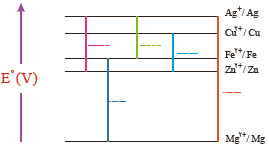
آ) نخست برای هر سلول گالوانی، آند و كاتد را مشخص كرده سپس emf را حساب كنید و در جای خالی بنویسید.
ب) اگر چند نیم سلول در اختیار داشته باشید و بخواهید از آنها یك سلول گالوانی با بیشترین ولتاژ بسازید، از كدام نیم سلول ها استفاده می کنید؟ چرا؟
5- با استفاده از جدول1، emf سلولی را حساب كنید كه واكنش اكسایش - كاهش زیر در آن رخ می دهد.
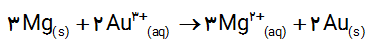
1-

2- روی آند و مس کاتد
3- آ) از روی شکل emf برابر 1/1 V می باشد.
ب) رابطه سمت چپ؛ با توجه به عدد نشان داده شده روی ولت متر که 1/1 می باشد می توان استنباط کرد که از رابطه سمت چپ استفاده شده است:
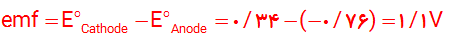
4- آ)
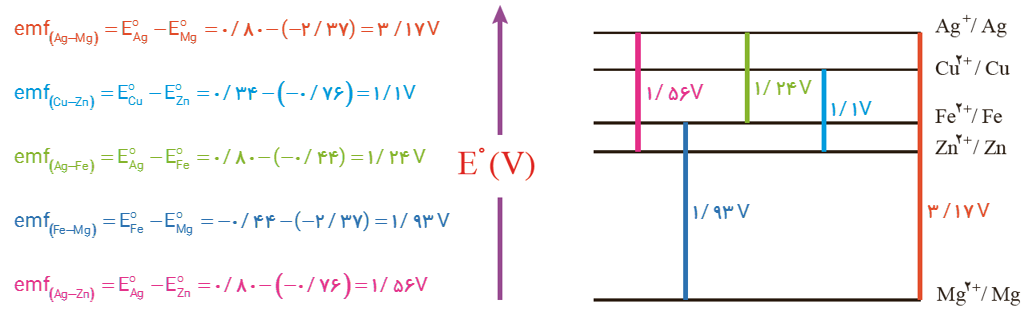
ب) از دو نیم سلول با بیشترین اختلاف پتانسیل؛ در اینجا از منیزیم به عنوان آند و از نقره به عنوان کاتد استفاده می کنیم.
5-
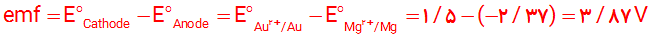
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه دوازدهم- آزمون آنلاین تمامی دروس پایه دوازدهم
- گام به گام تمامی دروس پایه دوازدهم
- ویدئو های آموزشی تمامی دروس پایه دوازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دوازدهم
- فلش کارت های آماده دروس پایه دوازدهم
- گنجینه ای جامع از انشاء های آماده پایه دوازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دوازدهم
خود را بیازمایید صفحه 51 درس آسایش و رفاه در سایه شیمی شیمی دوازدهم
پاسخ خود را بیازمایید صفحه 51 درس 2
جواب خود را بیازمایید صفحه 51 درس 2 شیمی دوازدهم
در هر یک از روش های زیر مراحل تبدیل انرژی شیمیایی موجود در یک سوخت به انرژی الکتریکی نشان داده شده است. با توجه به آن به پرسش ها پاسخ دهید
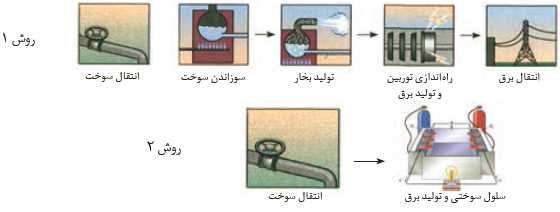
آ) در کدام روش اتلاف انرژی به شکل گرما کمتر است؟ چرا؟
ب) کدام روش کارایی بالاتری دارد؟ توضیح دهید
آ) روش 2 ، هرچه مراحل تبدیل و انتقال انرژی کمتر باشد ، میزان اتلاف انرژی به شکل گرما کمتر است .
ب) روش 2 ، هرچه میزان اتلاف انرژی به شکل گرما کمتر باشد ، کارآیی ( بازده ) بیشتر است .
گام به گام کتاب های پایه دوازدهم
گام به گام جامع کتاب شیمی دوازدهم
گام به گام جامع کتاب فارسی دوازدهم
گام به گام جامع کتاب نگارش دوازدهم
گام به گام جامع کتاب عربی دوازدهم
گام به گام جامع کتاب زبان انگلیسی دوازدهم
گام به گام جامع کتاب کتاب کار انگلیسی دوازدهم
گام به گام جامع کتاب دین و زندگی دوازدهم
گام به گام جامع کتاب هویت اجتماعی
گام به گام جامع کتاب سلامت و بهداشت
گام به گام جامع کتاب مدیریت خانواده و سبک زندگی (پسران)
با هم بیندیشیم صفحه 52 درس آسایش و رفاه در سایه شیمی شیمی دوازدهم
پاسخ با هم بیندیشیم صفحه 52 درس 2
جواب با هم بیندیشیم صفحه 52 درس 2 شیمی دوازدهم
1ــ با توجه به واکنش کلی سلول سوختی هیدروژن ــ اکسیژن به پرسش های زیر پاسخ دهید.
آ) ساختار الکترون ــ نقطه ای گونه های شرکت کننده را رسم کنید

ب) در هر ساختار:
- به ازای هر جفت الکترون پیوندی میان دو اتم یکسان، یک الکترون به هر اتم نسبت دهید.
- به ازای هر جفت الکترون پیوندی میان دو اتم متفاوت، هر دو الکترون را به اتم با خصلت نافلزی بیشتر نسبت دهید.
- همه الکترون های ناپیوندی روی هر اتم را به همان اتم نسبت دهید.
پ) الکترون های نسبت داده شده به هر اتم را بشمارید و آن را از شمار الکترون های ظرفیت همان اتم کم کنید. عدد به دست آمده عدد اکسایش اتم مورد نظر را نشان می دهد.
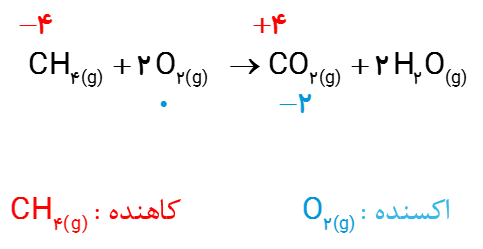
2ــ هرگاه بدانید که بیشتر شدن عدد اکسایش، نشان دهنده اکسایش یافتن و کمتر شدنآن نشان دهنده کاهش یافتن اتم هاست، در واکنش زیر گونه های اکسایش یافته، کاهش یافته، اکسنده و کاهنده را مشخص کنید.
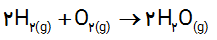
3- دانش آموزی نیم واکنش های انجام شده در نوعی سلول سوختی هیدروژن ــ اکسیژن را به صورت زیر از منابع علمی معتبر استخراج کرده است.
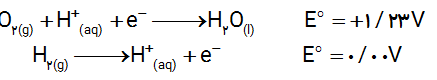
آ) با تعیین عدد اکسایش اتم ها، گونه های اکسنده و کاهنده را مشخص کنید.
ب) از دید محیط زیست گاز هیدروژن چه مزیتی نسبت به گاز متان دارد؟
1- آ)
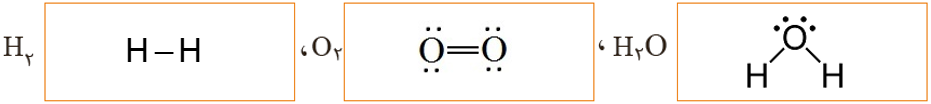
ب)
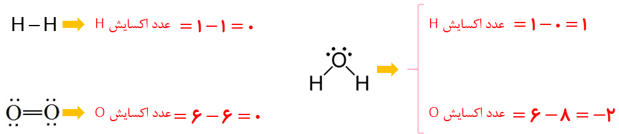
2-
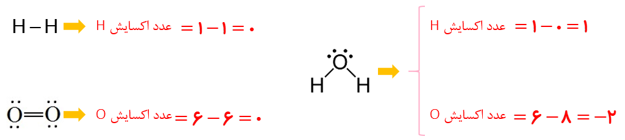
هیدروژن اکسایش یافته؛ زیرا عدد اکسایش آن بیشتر شده و اکسیژن کاهش یافته، زیرا عدد اکسایش آن کاهش یافته است.
3- آ)
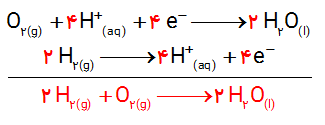
ب)

4- آ)
ب) با سوختن هیدروژن آب تولید می شود و گازگلخانه ای تولید نمی شود، با سوختن متان دی اکسید کربن و آب تولید می شود و یکی از گازهای مهم گلخانه ای بشمار می رود.
خود را بیازمایید صفحه 53 درس آسایش و رفاه در سایه شیمی شیمی دوازدهم
پاسخ خود را بیازمایید صفحه 53 درس 2
جواب خود را بیازمایید صفحه 53 درس 2 شیمی دوازدهم
1ــ در هر مورد با تعیین عدد اکسایش مشخص کنید که آن اتم اکسایش یا کاهش یافته است؟

2ــ در هر یک از واکنش های زیر با محاسبه تغییر عدد اکسایش، گونه کاهنده و اکسنده را تعیین کنید
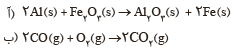
1-

2-
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه دوازدهم- آزمون آنلاین تمامی دروس پایه دوازدهم
- گام به گام تمامی دروس پایه دوازدهم
- ویدئو های آموزشی تمامی دروس پایه دوازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دوازدهم
- فلش کارت های آماده دروس پایه دوازدهم
- گنجینه ای جامع از انشاء های آماده پایه دوازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دوازدهم
خود را بیازمایید صفحه 54 درس آسایش و رفاه در سایه شیمی شیمی دوازدهم
پاسخ خود را بیازمایید صفحه 54 درس 2
جواب خود را بیازمایید صفحه 54 درس 2 شیمی دوازدهم
نیم واکنش های انجام شده در سلول الکترولیتی هنگام برق کافت آب به صورت زیر است:
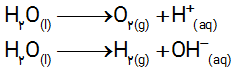
آ) با وارد کردن نماد الکترون در هر نیم واکنش مشخص کنید کدام نیم واکنش آندی و کدام کاتدی است؟
ب) هر یک از نیم واکنش ها را موازنه کنید و معادله کلی واکنش را به دست آورید.
پ) پیش بینی کنید کاغذ pH در محلول پیرامون آند و کاتد به چه رنگی درمیآید؟ چرا ؟
آ)
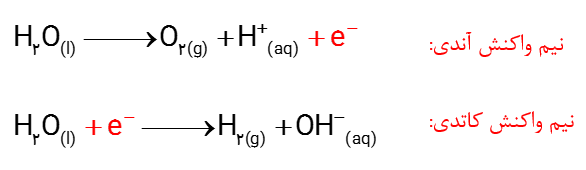
ب)
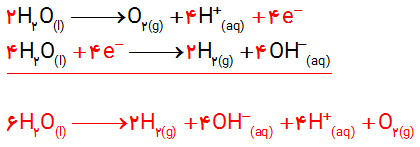
پ) پیرامون آند، این شناساگر به رنگ قرمز در می آید؛ زیرا یون هیدروژن تک بار مثبت در این محل تولید می شود.
پیرامون کاتد، این شناساگر به رنگ آبی در می آید؛ زیرا یون هیدروکسید در این محل تولید می شود.
گام به گام کتاب های پایه دوازدهم
گام به گام جامع کتاب شیمی دوازدهم
گام به گام جامع کتاب فارسی دوازدهم
گام به گام جامع کتاب نگارش دوازدهم
گام به گام جامع کتاب عربی دوازدهم
گام به گام جامع کتاب زبان انگلیسی دوازدهم
گام به گام جامع کتاب کتاب کار انگلیسی دوازدهم
گام به گام جامع کتاب دین و زندگی دوازدهم
گام به گام جامع کتاب هویت اجتماعی
گام به گام جامع کتاب سلامت و بهداشت
گام به گام جامع کتاب مدیریت خانواده و سبک زندگی (پسران)
خود را بیازمایید صفحه 55 درس آسایش و رفاه در سایه شیمی شیمی دوازدهم
پاسخ خود را بیازمایید صفحه 55 درس 2
جواب خود را بیازمایید صفحه 55 درس 2 شیمی دوازدهم
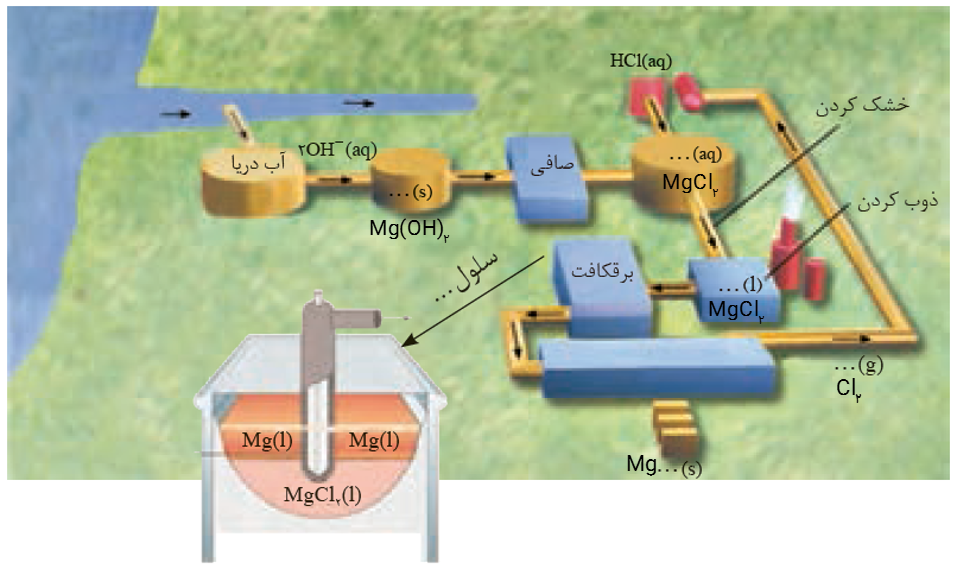
شکل صفحه بعد مراحل تهیه فلز منیزیم را ازآب دریا نشان می دهد. جاهای خالی را پرکرده و درباره این روش در کلاس گفت و گو کنید
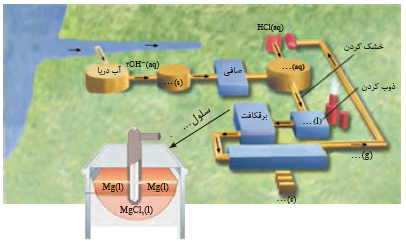
جواب به صورت زیر می باشد:
با هم بیندیشیم صفحه 57 درس آسایش و رفاه در سایه شیمی شیمی دوازدهم
پاسخ با هم بیندیشیم صفحه 57 درس 2
جواب با هم بیندیشیم صفحه 57 درس 2 شیمی دوازدهم
1- با توجه به شکل های زیر، به پرسش های مطرح شده پاسخ دهید.
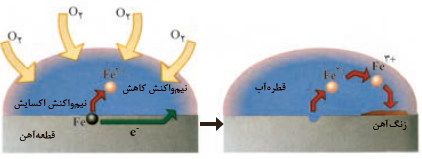
آ) چگونگی تشکیل زنگ آهن را توصیف کنید.
ب) هر یك از نیم واكنش های زیر را موازنه كنید.
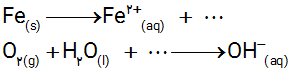
پ) با توجه به اینكه زنگ آهن حاوی یون آهن (III) است، نیم واكنش اكسایش یون آهن (II) به یون آهن (III) را بنویسید.
ت) فراورده نهایی خوردگی، زنگ آهن است. اگر فرمول شیمیایی آن را Fe(OH)3 در نظر بگیریم، معادله واكنش زیر را به روش وارسی موازنه كنید.
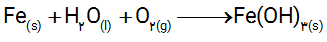
2- با توجه به نیم واكنش های زیر توضیح دهید چرا :
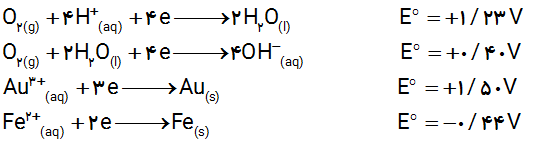
آ) خوردگی آهن در محیط اسیدی به میزان بیشتری رخ می دهد؟
ب) با گذشت زمان فلز طلا در هوای مرطوب و حتی در اعماق دریا همچنان درخشان باقی می ماند؟
1-آ) آهن در مجاورت با آب به صورت Fe2+(aq) اکسایش می یابد. سپس در اکسایشی دیگر، Fe2+(aq) به Fe3+(aq) تبدیل می شود. الکترون هایی که از آهن خارج می شوند با گاز اکسیژن موجود در آب و با مولکول آب ترکیب می شوند و تولید هیدروکسید می نمایند. در نتیجه ترکیب Fe3+(aq) با هیدروکسید، زنگ آهن (Fe(OH)3) تولید می شود.
ب)
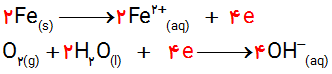
پ)
ت)
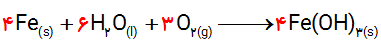
2- آ) از آن جا که پتانسیل کاهشی اکسیژن در محیط اسیدی بیشتر است، بنابراین بهتر آهن را اکسید کرده و خوردگی آهن بیشتر رخ می دهد.
ب) پتانسیل کاهشی استاندارد طلا در محیط مطلوب و اسیدی از اکسیژن بیشتر است، بنابراین اکسید نمی شود.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه دوازدهم- آزمون آنلاین تمامی دروس پایه دوازدهم
- گام به گام تمامی دروس پایه دوازدهم
- ویدئو های آموزشی تمامی دروس پایه دوازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دوازدهم
- فلش کارت های آماده دروس پایه دوازدهم
- گنجینه ای جامع از انشاء های آماده پایه دوازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دوازدهم
خود را بیازمایید صفحه 59 درس آسایش و رفاه در سایه شیمی شیمی دوازدهم
پاسخ خود را بیازمایید صفحه 59 درس 2
جواب خود را بیازمایید صفحه 59 درس 2 شیمی دوازدهم
شکل زیر بخشی از یک ورقه آهنی را نشان می دهد که با لایه نازکی از قلع پوشیده شده است. به این نوع آهن، حلبی می گویند. از ورقه های حلبی برای ساختن قوطی های روغن نباتی و کنسرو استفاده می شود. با مراجعه به جدول E0 :
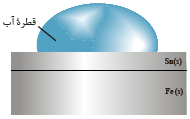
آ) در اثر ایجاد خراش در سطح این نوع آهن، کدام فلز خورده می شود؟ کدام فلز در برابر
خوردگی محافظت می شود؟
ب) نیم واکنش های اکسایش و کاهش را بنویسید.
پ) توضیح دهید چرا برخلاف حلبی از آهن گالوانیزه نمی توان برای ساختن ظروف بسته بندی مواد غذایی استفاده کرد؟
آ) آهن ، قلع
ب)
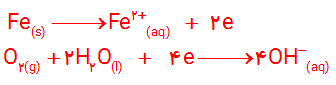
پ) زیرا فلز روی با مواد غذایی واکنش می دهد و باعث فساد و مسمومیت آنها می شود . اما قلع با مواد غذایی واکنش نمی دهد .
گام به گام کتاب های پایه دوازدهم
گام به گام جامع کتاب شیمی دوازدهم
گام به گام جامع کتاب فارسی دوازدهم
گام به گام جامع کتاب نگارش دوازدهم
گام به گام جامع کتاب عربی دوازدهم
گام به گام جامع کتاب زبان انگلیسی دوازدهم
گام به گام جامع کتاب کتاب کار انگلیسی دوازدهم
گام به گام جامع کتاب دین و زندگی دوازدهم
گام به گام جامع کتاب هویت اجتماعی
گام به گام جامع کتاب سلامت و بهداشت
گام به گام جامع کتاب مدیریت خانواده و سبک زندگی (پسران)
خود را بیازمایید صفحه 60 درس آسایش و رفاه در سایه شیمی شیمی دوازدهم
پاسخ خود را بیازمایید صفحه 60 درس 2
جواب خود را بیازمایید صفحه 60 درس 2 شیمی دوازدهم
شکل زیر آبکاری یک قاشق فولادی را با فلز نقره نشان می دهد با توجه به آن :
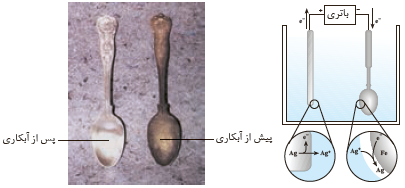
آ) قاشق فولادی به کدام قطب باتری متصل است؟
ب) نیم واکنش کاتدی را بنویسید.
پ) چرا الکترولیت را محلولی از نمک نقره انتخاب کرده اند؟
آ) منفی
ب)
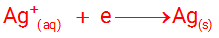
پ) از آنجا که روکش از جنس نقره است، بنابراین کاتیون های موجود در محلول باید از جنس نقره باشد تا با کاهش لایه ای از فلز نقره بر روی شیء موجو در کاتد بنشیند.
خود را بیازمایید صفحه 62 درس آسایش و رفاه در سایه شیمی شیمی دوازدهم
پاسخ خود را بیازمایید صفحه 62 درس 2
جواب خود را بیازمایید صفحه 62 درس 2 شیمی دوازدهم
لوحه آموزشی زیر، آبکاری یک قاشق مسی را با فلز نقره نشان می دهد. درباره آن در کلاس گفت و گو کنید
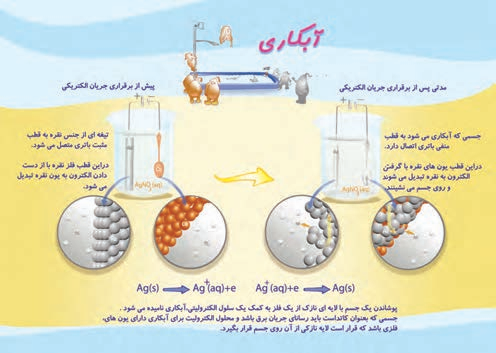
می خواهیم روی قاشق مسی روکشی از نقره قرار بگیرد. بنابراین قاشق را در کاتد سلول الکترولیتی قرار داده تیغه ای از نقره را در آند قرار می دهیم. محلول الکترولیت را یکی از نمک های محلول نقره انتخاب می کنیم. در آند یون های نقره از تیغه جدا شده و در کاتد، این یون ها با دریافت الکترون بر روی قاشق مسی می نشینند.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه دوازدهم- آزمون آنلاین تمامی دروس پایه دوازدهم
- گام به گام تمامی دروس پایه دوازدهم
- ویدئو های آموزشی تمامی دروس پایه دوازدهم
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس پایه دوازدهم
- فلش کارت های آماده دروس پایه دوازدهم
- گنجینه ای جامع از انشاء های آماده پایه دوازدهم
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه پایه دوازدهم
تمرین های دوره ای صفحه 63 درس آسایش و رفاه در سایه شیمی شیمی دوازدهم
پاسخ تمرین های دوره ای صفحه 63 درس 2
جواب تمرین های دوره ای صفحه 63 درس 2 شیمی دوازدهم
1 برای هر یک از جمله های زیر، دلیلی بنویسید.
آ فلز پلاتین را می توان در بخش های مختلف بدن هنگام جراحی به کار برد.
ب فلوئور، اكسنده ترین عنصر در جدول دوره ای است.
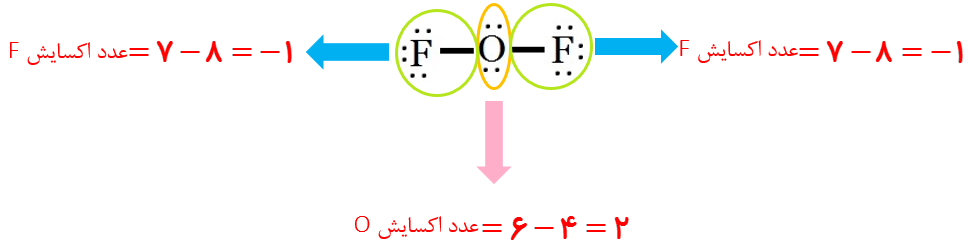
پ عدد اکسایش اکسیژن در OF2 برابر با 2+ است.
آ
پلاتین فلزی با واکنش پذیری کم و \({E^0} = 1/2V\) می تواند در بدن برای مدت های طولانی ویژگی های خود را حفظ کند.
ب
با توجه به شعاع و آرایش الکترونی فلوئور، تمایل اتم آن برای دریافت و یا کشیدن الکترون های موجود در یک پیوند بالا بوده (بالاترین تمایل به گرفتن الکترون نسبت به سایر عناصر)؛ بنابراین اکسنده ترین گونه در جدول پتانسیل کاهشی است.
پ
2 با مراجعه به جدول 1 توضیح دهید کدام نمودار تغییر غلظت یون ها را در سلول گالوانی روی_مس نشان می دهد.
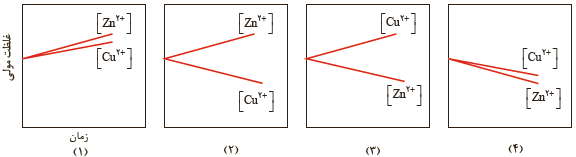
از آنجایی که پتانسیل کاهشی مس بزرگتر از پتانسیل کاهشی روی است، بنابراین در سلول گالوانی، روی آند و مس کاتد است. بنابراین با گذشت زمان از غلظت یون های دو بار مثبت مس در کاتد کاسته و بر غلظت یون های روی دو بار مثبت در آند افزوده می شود. بنابراین نمودار (2) تغییر غلظت را به درستی نشان می دهد.
3 emf سلولی كه واكنش زیر در آن رخ می دهد برابر با 1/98V است. \({E^0}\) نیم سلول A را حساب کرده و با مراجعه به جدول 1، مشخص کنید A کدام فلز است؟
\({A_{(s)}} + 2\,A{g^ + }_{(aq)}\;\; \to \,\,A_{(aq)}^ + + 2\,A{g_{(s)}}\)
\(\begin{array}{l}{E_{Cell}} = {E_{cathode}} - {E_{anode}} = \\\\{E_{Ag}} - {E_A} = 0/80 - {E_A}\\\\ \Rightarrow {E_A} = 0/80 - {E_{Cell}} = 0/80 - 1/98\\\\ \Rightarrow {E_A} - 1/18\,V\end{array}\)
با توجه به جدول این فلز منگنز است.
4 عدد اکسایش اتم نشان داده شده با ستاره را مشخص کنید.
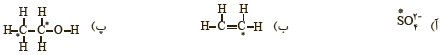
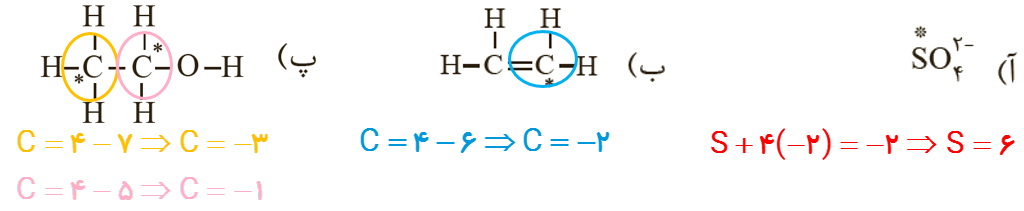
5 در هر یک از واکنش های زیر گونه های اکسنده و کاهنده را مشخص کنید
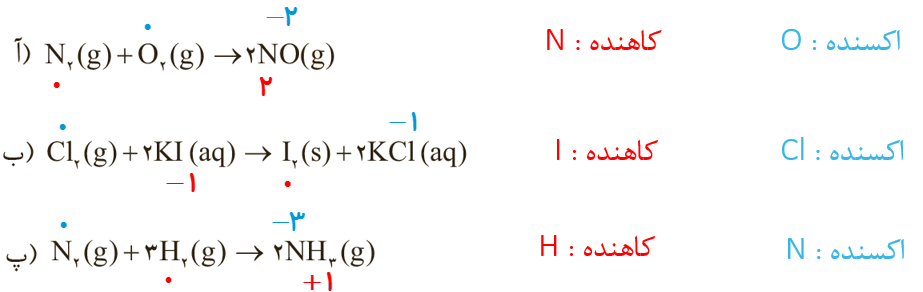
6 باتری های روی _ نقره از جمله باتری های دگمه ای هستند که در آنها واکنش زیر انجام می شود.
\(Z{n_{(s)}} + 2\,A{g_2}{O_{(s)}}\,\,\,\,\, \to \,\,\,\,\,Zn{O_{(s)}} + 2\,A{g_{(s)}}\)
آ گونه های اکسنده و کاهنده را در آن مشخص کنید.
ب آند و کاتد را در این باتری مشخص کنید.
آ
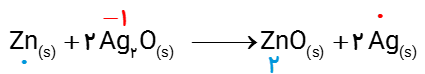
اتم Zn کاهنده و یون Ag+ اکسنده .
ب
در این باتری ها آند به عنوان قطب منفی (-) یعنی Ag و کاتد را به عنوان قطب مثبت (+) یعنی Zn است.
7 با توجه به جدول زیر به پرسش ها پاسخ دهید.
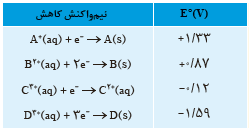
آ کدام گونه قوی ترین و کدام ضعیف ترین اکسنده است؟
ب کدام گونه قوی ترین و کدام ضعیف ترین کاهنده است؟
پ کدام گونه (ها) می توانند \({C^{2 + }}\) را اکسید کنند؟
آ
اکسنده قوی بهتر کاهش می دهد؛ یعنی پتانسیل کاهشی بزرگتری دارد: \({A^ + }_{(aq)}\)
اکسنده ضعیف پتانسیل کاهشی کوچکتری دارد: \({D^ + }_{(aq)}\)
ب
هر چه پتانسیل کاهشی یک نیم واکنش کمتر باشد، گونه سمت راست آن کاهنده قوی تری است: \({D_{(s)}}\)
اکسنده ضعیف پتانسیل کاهشی کوچکتری دارد: \({A_{(s)}}\)
پ
هر گونه ای که پتانسیل کاهشی بیشتری را نسبت به نیم واکنش \({C^{3 + }}\) داشته باشد، می تواند \({C^{2 + }}\) را اکسید کند: \({B^{2 + }}_{(aq)}\) و \(.\,{A^{2 + }}_{(aq)}\)
8 با توجه به واکنش های زیر به طور طبیعی انجام می شوند گونه های کاهنده و گونه های اکسنده را بر حسب کاهش قدرت مرتب کنید؟
\(\begin{array}{l}2C{r^{2 + }}(aq) + S{n^{2 + }}(aq) \to 3C{r^{3 + }}(aq) + Sn(s)\\\\Fe(s) + 2C{r^{3 + }}(aq) \to F{e^{2 + }}(aq) + 2C{r^{2 + }}(aq)\end{array}\)

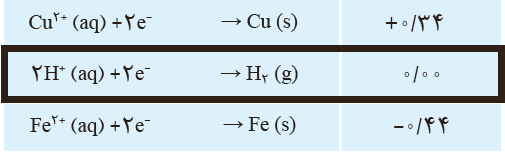
9 با توجه به جدول پتانسیل های کاهشی استاندارد توضیح دهید محلول هیدروکلریک اسید را در کدام ظرف (مسی یا آهنی) می توان نگه داشت؟
\({E^0}_{(SHE)} = 0\,V\) ؛ از آن جا که این محلول حاوی یون های \({H^ + }_{(aq)}\) است که پتانسیل کاهشی این گونه نیز برابر صفر است و با توجه به جایگاه مس و آهن در جدول کاهشی و منفی بودن این عدد برای آهن می توان نتیجه گرفت آهن بر خلاف مس در مجاورت محلول اسید واکنش می دهد. به عبارتی ظرف آهنی دچار خوردگی می شود اما ظرف مسی واکنشی با محلول هیدرو کلریک اسید نمی دهد:
10 به قدرمطلق پتانسيل كاهشی استاندارد دو نیم سلول زير توجه کنید. هنگامی که اين دو نيم سلول را به هم وصل می كنيم، جريان الكتریكی از نیم سلول X به نیم سلول Y برقرار می شود اما با اتصال نيم سلول X به SHE، الكترون ها از نيم سلول X به سمت SHE جاری می شوند. نيروی الكتروموتوری سلول گالوانی از اين دو نيم سلول را حساب كنيد.
\(\begin{array}{l}{Y^{2 + }} + 2{e^ - } \to Y\,\,\,\,\,\,\,\,\,\,\,\left| {{E^0}} \right| = 0/34\,V\\\\{X^{2 + }} + 2{e^ - } \to X\,\,\,\,\,\,\,\,\,\,\,\left| {{E^0}} \right| = 0/25\,V\end{array}\)
مرحله ۱: تعیین علامت پتانسیلها
الف نیم سلول X:
مسئله میگوید وقتی نیمسلول X به SHE (نیمسلول استاندارد هیدروژن) متصل میشود، الکترونها از X به سمت SHE جاری میشوند.
در یک سلول گالوانی، الکترونها همیشه از آند (قطب با پتانسیل کاهشی پایینتر) به کاتد (قطب با پتانسیل کاهشی بالاتر) حرکت میکنند.
چون پتانسیل استاندارد SHE برابر با صفر ولت است \(({E^ \circ }_{SHE} = 0\,V)\) و X نقش آند را دارد، پس پتانسیل آن باید از صفر کمتر باشد.
بنابراین، \({E^ \circ }\) برای نیم سلول X منفی است:
\(E_X^ \circ = - 0/25\,V\)
ب نیم سلول Y:
مسئله میگوید وقتی نیمسلولهای X و Y به هم وصل میشوند، جریان الکتریکی از X به Y برقرار میشود.
این یعنی در این سلول، X آند و Y کاتد است.
در نتیجه، پتانسیل کاهشی Y باید از پتانسیل کاهشی X بزرگتر باشد \(.\,(E_Y^ \circ > E_X^ \circ )\)
با توجه به اینکه \(\left| {E_Y^ \circ } \right| = 0/34\,V\) و \(E_X^ \circ = - 0/25\,V\) تنها مقداری که شرط \(E_Y^ \circ > - 0/25\,V\) را برآورده میکند، مقدار مثبت است.
بنابراین، \({E^ \circ }\) برای نیم سلول Y مثبت است:
\(E_Y^ \circ = + 0/34\,V\)
مرحله ۲: محاسبه نیروی الکتروموتوری (EMF)
حالا که پتانسیلهای استاندارد هر دو نیمسلول را داریم، میتوانیم EMF سلول را با استفاده از فرمول زیر محاسبه کنیم:
\(E_{cell}^ \circ = E_{Cathode}^ \circ - E_{Anode}^ \circ \)
کاتد (قطب مثبت): نیم سلول Y با \(E_Y^ \circ = + 0/34\,V\)
آند (قطب منفی): نیم سلول X با \(E_X^ \circ = - 0/25\,V\)
\(E_{cell}^ \circ = ( + 0/34\,V) - ( - 0/25\,V) = 0/59\,V\)
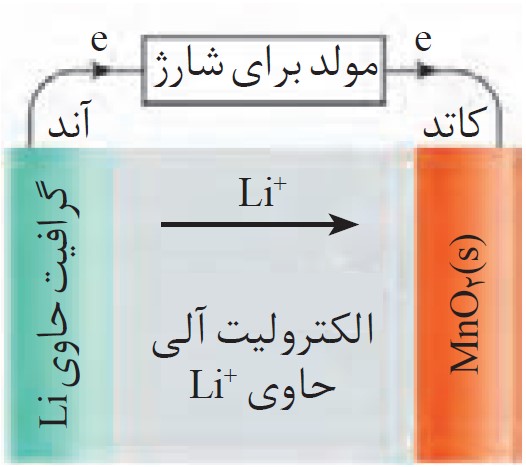
11 اگر کاتد نوعی باتری لیتیمی که در تلفن همراه به کار می رود، حاوی \(Mn{O_2}(s)\) باشد؛ نیم واکنش ها به شکل زیر خواهند بود:
\(\begin{array}{l}Li(s) \to L{i^ + }(s) + e\\\\Mn{O_2}(s) + L{i^ + }(s) + e \to Li\,Mn{O_2}(s)\end{array}\)
آ عدد اکسایش Mn را در \(Mn{O_2}(s)\) و \(Li\,Mn{O_2}(s)\) تعیین کنید.
ب هنگامی که تلفن یا رایانه همراه روشن است و باتری نقش سلول گالوانی را دارد، چگونگی جابه جایی الکترون ها و یون های لیتیم را توصیف کنید.
پ هنگامی که تلفن یا رایانه همراه در حال شارژ شدن است و باتری نقش سلول الکترولیتی را دارد، چگونگی جابه جایی الکترون ها و یون های لیتیم را توصیف کنید.
آ تعیین عدد اکسایش منگنز (Mn)
برای پیدا کردن عدد اکسایش، از این قاعدهٔ کلیدی استفاده میکنیم که مجموع اعداد اکسایش در یک ترکیب خنثی، برابر با صفر است.
در ترکیب \(:\,Mn{O_2}\)
1 عدد اکسایش اکسیژن (O) معمولاً ۲- است.
2 چون دو اتم اکسیژن داریم، مجموع بار آنها 2 × (-2) = -4 میشود.
3 برای اینکه کل ترکیب خنثی (صفر) باشد، عدد اکسایش منگنز (Mn) باید ۴+ باشد.
(+4) + (-4) = 0
4 با حل این معادله ساده، عدد اکسایش منگنز (Mn) برابر با ۳+ به دست میآید.
نتیجه: عدد اکسایش منگنز از ۴+ به ۳+ کاهش یافته است، که نشاندهندهٔ نیمواکنش کاهش در کاتد است.
ب هنگام کار کردن باتری (تخلیه یا Discharge)
وقتی تلفن همراهت روشن است، باتری مانند یک سلول گالوانی عمل کرده و انرژی الکتریکی تولید میکند.
جریان الکترونها: الکترونها در آند (الکترود لیتیم) تولید میشوند و از طریق مدارهای داخلی تلفن همراه (مدار بیرونی) به سمت کاتد (الکترود \(Mn{O_2}\)) حرکت میکنند تا در آنجا مصرف شوند. این جریان الکترون است که به دستگاه تو انرژی میدهد.
جریان یونهای لیتیم \(:\,(L{i^ + })\) همزمان، یونهای لیتیم \((L{i^ + })\) که در آند به وجود آمدهاند، از طریق محلول الکترولیت از سمت آند به سمت کاتد حرکت میکنند تا در واکنش کاهش شرکت کنند.
پ هنگام شارژ شدن باتری (Charge)
وقتی تلفن را به شارژر وصل میکنی، باتری مانند یک سلول الکترولیتی عمل میکند و شارژر با اعمال ولتاژ، واکنشها را در جهت عکس انجام میدهد.
جریان الکترونها: شارژر، الکترونها را از الکترود \(Mn{O_2}\) (که حالا نقش آند را دارد) میگیرد و آنها را از طریق سیم شارژر به سمت الکترود لیتیم (که حالا نقش کاتد را دارد) هدایت میکند.
جریان یونهای لیتیم \(:\,(L{i^ + })\) یونهای لیتیم \((L{i^ + })\) از الکترود \(Mn{O_2}\) جدا شده و از طریق محلول الکترولیت به سمت الکترود دیگر حرکت میکنند تا در آنجا با گرفتن الکترون، دوباره به اتم لیتیم تبدیل شده و باتری برای استفادهٔ مجدد آماده شود.
این فرایند دقیقاً در شکل زیر نمایش داده شده است:
12 شیمی دان ها در برخی سلول های الکتروشیمیایی برای انجام واکنش اکسایش-کاهش از نور بهره می برند و آنها را سلول نور الکتروشیمیایی می نامند.
در نمونه ای از آنها که برای تهیه گاز هیدروژن از آب به کار می رود، با توجه به نیم واکنش های زیر:
\(\begin{array}{l}Si{O_2}(s) + 4\,H_{}^ + (aq) + 4\,e\;\; \to Si(s) + 2\,{H_2}O(l)\quad ,\quad {E^ \circ } = - 0/84\,V\\\\2\,{H_2}O(l) + 2\,e \to {H_2}(g) + 2O\,H_{}^ - (aq)\begin{array}{*{20}{c}}{}&{}&{}&{}\end{array},\;\;{\kern 1pt} {\kern 1pt} {E^ \circ } = - 0/83\,V\end{array}\)
آ نیم سلول آند و کاتد را مشخص و emf سلول را حساب کنید.
ب یافته های تجربی نشان می دهند که افزون بر emf، بازده و سرعت انجام واکنش در این سلول پایین است، با این توصیف چرا برخی استفاده از آنها را برای تهیه گاز هیدروژن مناسب می دانند؟

آ
نیم سلول آندی:
\(Si{O_2}_{(s)} + 4\,H_{(aq)}^ + + 4\,e\;\; \to S{i_{(s)}} + 2\,{H_2}{O_{(l)}}\quad ,\quad {E^ \circ } = - 0/84\,V\)
نیم سلول کاتدی:
\(\begin{array}{l}2\,{H_2}{O_{(l)}} + 2\,e \to {H_2}_{(g)} + 2O\,H_{(aq)}^ - \begin{array}{*{20}{c}}{}&{}&{}&{}\end{array}\;\;{\kern 1pt} {\kern 1pt} {E^ \circ } = - 0/83\,V\\\\ \Rightarrow {E_{Cell}} = {E_{cathode}} - {E_{anode}} = - 0/83 - ( - 0/84) = 0/01\,V\end{array}\)
ب
1 تولید گاز H2 برای سلول خورشیدی
2 استفاده از انرژی پاک خورشید
3 انرژی رایگان خورشید
13 در یک آزمایش چهار فلز A ، B ، C و D رفتارهای زیر را نشان داده اند:
فقط فلزهای A و C با محلول 0/1 مولار هیدروکلریک اسید واکنش می دهند و گاز هیدروژن تولید می کنند.
با قرار دادن فلز C در محلول های حاوی یون های \({A^{2 + }}\,,\,{B^{2 + }}\,,\,{D^{2 + }}\) به ترتیب فلزهای D، B و A رسوب می کنند.
یون \({B^{2 + }}(aq)\) اکسنده قوی تری از \({D^{2 + }}(aq)\) است.
بر اساس دادههای آزمایش، ترتیب کاهندگی این چهار فلز از قوی به ضعیف به صورت زیر است:
C > A > D > B
چگونه به این نتیجه رسیدیم؟ (تحلیل گام به گام)
برای رسیدن به پاسخ، هر کدام از سرنخها را جداگانه بررسی میکنیم:
سرنخ ۱: واکنش با اسید
داده: فقط فلزهای A و C با هیدروکلریک اسید واکنش میدهند و گاز هیدروژن \(({H_2})\) تولید میکنند.
اصل کلیدی: فلزی میتواند با اسید واکنش دهد و \({H_2}\) آزاد کند که کاهندهتر از هیدروژن باشد (یعنی پتانسیل کاهشی منفی داشته باشد).
نتیجهگیری:
- قدرت کاهندگی A و C از هیدروژن بیشتر است.
- قدرت کاهندگی B و D از هیدروژن کمتر است.
- بنابراین، دو فلز قویتر ما A و C هستند و دو فلز ضعیفتر، B و D.
سرنخ ۲: واکنش فلز C با یونهای دیگر
داده: فلز C، یونهای فلزهای A، B و D را از محلولِ شان خارج کرده و به شکل فلز جامد رسوب میدهد.
اصل کلیدی: یک فلز کاهنده، تنها میتواند یونهای فلزی را کاهش دهد (رسوب دهد) که از خودش کاهندهٔ ضعیفتری باشد.
نتیجهگیری:
- فلز C از هر سه فلز دیگر کاهندهتر است.
- با این سرنخ، قویترین کاهنده را پیدا کردیم: فلز C .
سرنخ ۳: مقایسه قدرت اکسندگی یونها
داده: یون \({B^{2 + }}\) اکسندهٔ قویتری از یون \({D^{2 + }}\) است.
اصل کلیدی: قدرت اکسندگی یون یک فلز، با قدرت کاهندگی خود آن فلز رابطهٔ عکس دارد. یعنی هرچه یون یک فلز اکسندهتر باشد، خود فلز کاهندهتر است.
نتیجهگیری:
چون یون \({B^{2 + }}\) اکسنده تر از یون \({D^{2 + }}\) است، پس فلز D کاهندهتر از فلز B است.
D > B
جمعبندی نهایی
حالا تمام قطعات پازل را کنار هم میگذاریم:
از سرنخ ۲ فهمیدیم که C از همه قویتر است.
از سرنخ ۱ فهمیدیم که A و C قویتر از B و D هستند. پس A در رتبه دوم قرار میگیرد.
از سرنخ ۳ فهمیدیم که بین دو فلز ضعیفتر، D از B قویتر است.
بنابراین، ترتیب نهایی قدرت کاهندگی به این صورت مشخص میشود: C > A > D > B
14 جدول روبه رو نيروی الكتروموتوری سه سلول گالوانی را نشان می دهد؛ اگر \({E^ \circ }\,({C^{2 + }}/C) = - 0/14\,V\) و در این سلول ها، نیم سلول کاتد باشد:
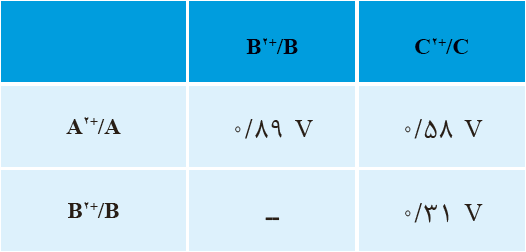
آ پتانسیل کاهشی استاندارد را برای دو نیم سلول \({A^{2 + }}/A\) و \({B^{2 + }}/B\) به دست آورید.
ب نماد شیمیایی اکسنده ترین و کاهنده ترین گونه را بنویسید.
آ محاسبه پتانسیل کاهشی استاندارد
با استفاده از اطلاعات داده شده، پتانسیلهای کاهشی استاندارد \(({E^ \circ })\) برای نیمسلولهای A و B به صورت زیر محاسبه میشوند:
پتانسیل نیم سلول A:
در سلول گالوانی A-C، نیروی الکتروموتوری (emf) برابر با ۰/۳۰ ولت است و نیمسلول C کاتد است.
با استفاده از فرمول \(E_{cell}^ \circ = E_{Cathode}^ \circ - E_{Anode}^ \circ \) داریم:
\(\begin{array}{l}0/30\,V = {E^ \circ }({C^{2 + }}/C) - {E^ \circ }({A^{2 + }}/A)\\\\ \Rightarrow 0/30\,V = ( - 0/84\,V) - {E^ \circ }({A^{2 + }}/A)\\\\ \Rightarrow {E^ \circ }({A^{2 + }}/A) = - 0/84\,V - 0/30\,V = - 1/14\,V\end{array}\)
پتانسیل نیم سلول B :
در سلول گالوانی B-C، نیروی الکتروموتوری برابر با 1/04 ولت است و نیمسلول C کاتد است.
با استفاده از همان فرمول داریم:
\(\begin{array}{l}1/04\,V = {E^ \circ }({C^{2 + }}/C) - {E^ \circ }({B^{2 + }}/B)\\\\ \Rightarrow 1/04\,V = ( - 0/84\,V) - {E^ \circ }({B^{2 + }}/B)\\\\ \Rightarrow {E^ \circ }({B^{2 + }}/B) = - 0/84\,V - 1/04\,V = - 1/88\,V\end{array}\)
ب تعیین اکسندهترین و کاهندهترین گونه
برای تعیین قویترین اکسنده و کاهنده، پتانسیلهای کاهشی استاندارد سه نیمسلول را مقایسه میکنیم:
\(\begin{array}{l}{E^ \circ }({C^{2 + }}/C) = - 0/84\,V\\\\{E^ \circ }({A^{2 + }}/A) = - 1/14\,V\\\\{E^ \circ }({B^{2 + }}/B) = - 1/88\,V\end{array}\)
اکسندهترین گونه: گونهای است که بیشترین تمایل را برای کاهش یافتن دارد، یعنی دارای بالاترین (منفیترینِ کمتر) پتانسیل کاهشی است. در میان یونهای \({C^{2 + }}\,,\,{B^{2 + }}\,,\,{A^{2 + }}\) ، یون \({C^{2 + }}\) با پتانسیل \({E^ \circ } = - 0/84\,V\) قویترین اکسنده است.
کاهندهترین گونه: گونهای است که بیشترین تمایل را برای اکسید شدن دارد، یعنی دارای پایینترین (منفیترینِ بیشتر) پتانسیل کاهشی است. در میان فلزهای A، B و C، فلز B با پتانسیل \({E^ \circ } = - 1/88\,V\) قویترین کاهنده است.
15 با توجه به شکل به پرسش ها پاسخ دهید.
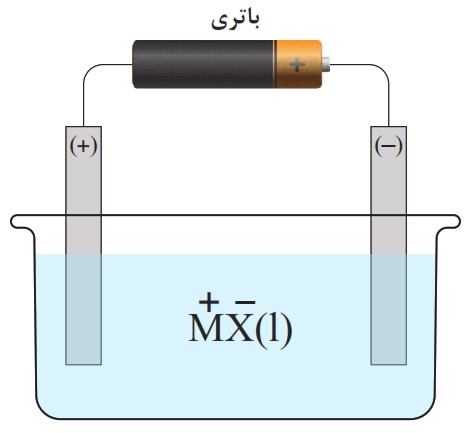
آ این سلول گالوانی است یا الکترولیتی؟ چرا؟
ب در سطح کدام الکترود، نیم واکنش اکسایش رخ می دهد؟ چرا؟
پ در سطح کدام الکترود، اتم های M پدید می آیند؟ چرا؟
ت در سطح کدام الکترود از یون ها، الکترون آزاد می شود؟
آ
این سلول یک سلول الکترولیتی است؛ زیرا برای انجام واکنش شیمیایی از یک منبع انرژی خارجی (یک باتری) استفاده میکند. سلولهای الکترولیتی انرژی الکتریکی را مصرف میکنند تا یک واکنش غیر خودبهخودی را به انجام برسانند، در حالی که سلولهای گالوانی خودشان انرژی الکتریکی تولید میکنند.
ب
نیمواکنش اکسایش در سطح الکترود مثبت (+) رخ میدهد؛ در یک سلول الکترولیتی، الکترود مثبت، آند نامیده میشود. یونهای منفی (آنیون ها یا \(({X^ - }\) به سمت این الکترود جذب میشوند و با از دست دادن الکترون، اکسید میشوند. اکسایش به معنای از دست دادن الکترون است.
پ
اتمهای M در سطح الکترود منفی (-) پدید میآیند؛ الکترود منفی، کاتد نامیده میشود. یونهای مثبت (کاتیونها یا \(({M^ + }\) به سمت این الکترود کشیده میشوند و در آنجا با گرفتن الکترون، کاهش یافته و به اتمهای خنثی M تبدیل میشوند.
ت
الکترون از یونها در سطح الکترود مثبت (+) آزاد میشود؛ آزاد شدن الکترون همان فرایند اکسایش است. همانطور که در قسمت (ب) توضیح داده شد، یونهای منفی \({X^ - }\) در الکترود مثبت الکترونهای خود را از دست میدهند (آزاد میکنند).
16 می دانید که برای استفاده از هر سلول الکترولیتی به یک مولد یا باتری (سلول گالوانی) نیاز است، شکل روبه رو این ویژگی را نشان می دهد.
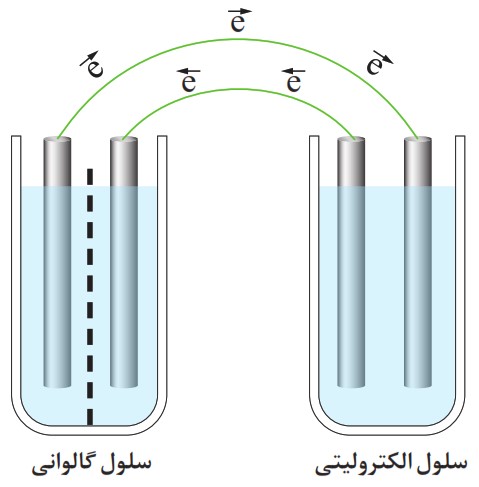
نخست آند و کاتد را برای هر الکترود در هر سلول مشخص کنید، سپس روند انجام فرایند جابه جایی الکترون ها را هنگام استفاده از یک سلول الکترولیتی توضیح دهید.
۱ تعیین آند و کاتد
برای تشخیص آند و کاتد، همیشه به فرآیند اکسایش (از دست دادن الکترون) و کاهش (گرفتن الکترون) توجه میکنیم.
سلول گالوانی (باتری - سمت چپ):
- آند (قطب منفی): الکترودی که در آن اکسایش رخ میدهد و الکترون تولید میکند (الکترود سمت چپ در شکل).
- کاتد (قطب مثبت): الکترودی که در آن کاهش رخ میدهد و الکترونها را مصرف میکند (الکترود سمت راست در شکل).
سلول الکترولیتی (سمت راست):
- کاتد (قطب منفی): این الکترود به قطب منفی باتری وصل است، الکترون دریافت میکند و در آن کاهش رخ میدهد (الکترود سمت چپ).
- آند (قطب مثبت): این الکترود به قطب مثبت باتری وصل است، الکترون از دست میدهد و در آن اکسایش رخ میدهد (الکترود سمت راست).
۲ روند جابهجایی الکترونها
روند جابجایی الکترون در این سیستم مانند یک مدار الکتریکی عمل میکند که در آن سلول گالوانی نقش منبع تغذیه یا پمپ الکترون را ایفا میکند.
الف تولید الکترون: در سلول گالوانی، یک واکنش شیمیایی خودبهخودی اتفاق میافتد. در آند این سلول، اکسایش رخ داده و الکترونها آزاد میشوند.
ب پمپاژ الکترون: این الکترونها از طریق سیم به کاتد سلول الکترولیتی منتقل میشوند. در واقع، باتری الکترونها را به این الکترود «پمپ» میکند.
پ کشش الکترون: همزمان، قطب مثبت باتری (کاتد سلول گالوانی) الکترونها را از آند سلول الکترولیتی به سمت خود میکشد.
ت انجام واکنش غیر خودبهخودی: این جریان اجباری الکترون که توسط باتری ایجاد شده، باعث میشود در سلول الکترولیتی یک واکنش شیمیایی غیر خودبهخودی انجام شود:
- یونهای مثبت در محلول به سمت کاتد (قطب منفی) حرکت کرده و با گرفتن الکترون، کاهش مییابند.
- یونهای منفی در محلول به سمت آند (قطب مثبت) حرکت کرده و با از دست دادن الکترون، اکسایش مییابند.
به طور خلاصه، سلول گالوانی انرژی شیمیایی را به انرژی الکتریکی تبدیل میکند تا سلول الکترولیتی بتواند انرژی الکتریکی را مصرف کرده و یک واکنش شیمیایی دلخواه را به انجام برساند.



1736019749.png)















