جواب تمرین های دوره ای صفحه 63 درس 2 شیمی دوازدهم (آسایش و رفاه در سایه شیمی)
تعداد بازدید : 84.72Mپاسخ تمرین های دوره ای صفحه 63 شیمی دوازدهم
-گام به گام تمرین های دوره ای صفحه 63 درس آسایش و رفاه در سایه شیمی
-تمرین های دوره ای صفحه 63 درس 2
-شما در حال مشاهده جواب تمرین های دوره ای صفحه 63 شیمی دوازدهم هستید. ما در تیم مای درس، پاسخنامههای کاملاً تشریحی و استاندارد را مطابق با آخرین تغییرات کتاب درسی 1404 برای شما گردآوری کردهایم. اگر به دنبال بهروزترین پاسخها برای این صفحه هستید و میخواهید بدون نیاز به اتصال به اینترنت، علاوه بر پاسخهای گام به گام، به گنجینهای از مطالب درسی دسترسی پیدا کنید، حتماً اپلیکیشن مایدرس را نصب نمایید.
📥 دانلود اپلیکیشن مایدرس
برای دسترسی آفلاین، سریع و بدون نیاز به اینترنت به گنجینهای از گامبهگامها و نمونه سوالات، اپلیکیشن را نصب کنید.
1 برای هر یک از جمله های زیر، دلیلی بنویسید.
آ فلز پلاتین را می توان در بخش های مختلف بدن هنگام جراحی به کار برد.
ب فلوئور، اكسنده ترین عنصر در جدول دوره ای است.
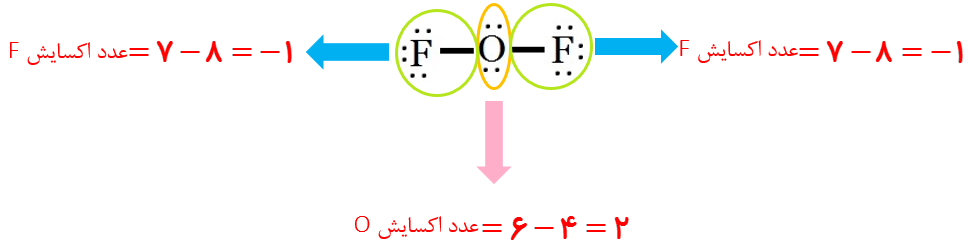
پ عدد اکسایش اکسیژن در OF2 برابر با 2+ است.
آ
پلاتین فلزی با واکنش پذیری کم و \({E^0} = 1/2V\) می تواند در بدن برای مدت های طولانی ویژگی های خود را حفظ کند.
ب
با توجه به شعاع و آرایش الکترونی فلوئور، تمایل اتم آن برای دریافت و یا کشیدن الکترون های موجود در یک پیوند بالا بوده (بالاترین تمایل به گرفتن الکترون نسبت به سایر عناصر)؛ بنابراین اکسنده ترین گونه در جدول پتانسیل کاهشی است.
پ
2 با مراجعه به جدول 1 توضیح دهید کدام نمودار تغییر غلظت یون ها را در سلول گالوانی روی_مس نشان می دهد.
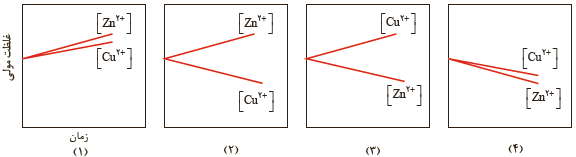
از آنجایی که پتانسیل کاهشی مس بزرگتر از پتانسیل کاهشی روی است، بنابراین در سلول گالوانی، روی آند و مس کاتد است. بنابراین با گذشت زمان از غلظت یون های دو بار مثبت مس در کاتد کاسته و بر غلظت یون های روی دو بار مثبت در آند افزوده می شود. بنابراین نمودار (2) تغییر غلظت را به درستی نشان می دهد.
3 emf سلولی كه واكنش زیر در آن رخ می دهد برابر با 1/98V است. \({E^0}\) نیم سلول A را حساب کرده و با مراجعه به جدول 1، مشخص کنید A کدام فلز است؟
\({A_{(s)}} + 2\,A{g^ + }_{(aq)}\;\; \to \,\,A_{(aq)}^ + + 2\,A{g_{(s)}}\)
\(\begin{array}{l}{E_{Cell}} = {E_{cathode}} - {E_{anode}} = \\\\{E_{Ag}} - {E_A} = 0/80 - {E_A}\\\\ \Rightarrow {E_A} = 0/80 - {E_{Cell}} = 0/80 - 1/98\\\\ \Rightarrow {E_A} - 1/18\,V\end{array}\)
با توجه به جدول این فلز منگنز است.
4 عدد اکسایش اتم نشان داده شده با ستاره را مشخص کنید.
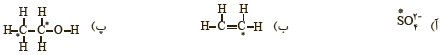
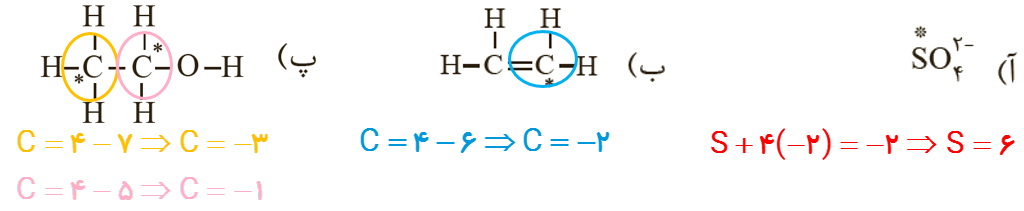
5 در هر یک از واکنش های زیر گونه های اکسنده و کاهنده را مشخص کنید
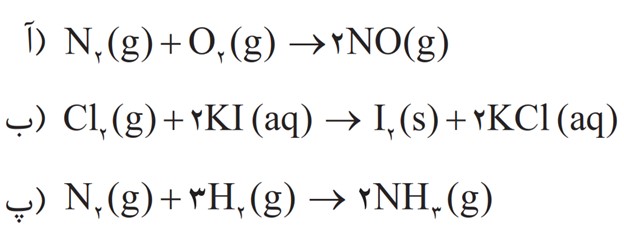
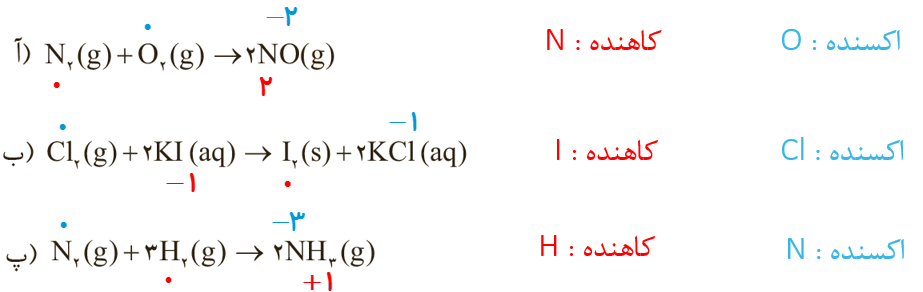
6 باتری های روی _ نقره از جمله باتری های دگمه ای هستند که در آنها واکنش زیر انجام می شود.
\(Z{n_{(s)}} + 2\,A{g_2}{O_{(s)}}\,\,\,\,\, \to \,\,\,\,\,Zn{O_{(s)}} + 2\,A{g_{(s)}}\)
آ گونه های اکسنده و کاهنده را در آن مشخص کنید.
ب آند و کاتد را در این باتری مشخص کنید.
آ
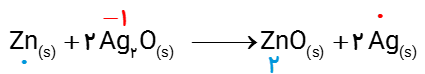
اتم Zn کاهنده و یون Ag+ اکسنده .
ب
در این باتری ها آند به عنوان قطب منفی (-) یعنی Ag و کاتد را به عنوان قطب مثبت (+) یعنی Zn است.
7 با توجه به جدول زیر به پرسش ها پاسخ دهید.
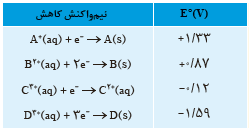
آ کدام گونه قوی ترین و کدام ضعیف ترین اکسنده است؟
ب کدام گونه قوی ترین و کدام ضعیف ترین کاهنده است؟
پ کدام گونه (ها) می توانند \({C^{2 + }}\) را اکسید کنند؟
آ
اکسنده قوی بهتر کاهش می دهد؛ یعنی پتانسیل کاهشی بزرگتری دارد: \({A^ + }_{(aq)}\)
اکسنده ضعیف پتانسیل کاهشی کوچکتری دارد: \({D^ + }_{(aq)}\)
ب
هر چه پتانسیل کاهشی یک نیم واکنش کمتر باشد، گونه سمت راست آن کاهنده قوی تری است: \({D_{(s)}}\)
اکسنده ضعیف پتانسیل کاهشی کوچکتری دارد: \({A_{(s)}}\)
پ
هر گونه ای که پتانسیل کاهشی بیشتری را نسبت به نیم واکنش \({C^{3 + }}\) داشته باشد، می تواند \({C^{2 + }}\) را اکسید کند: \({B^{2 + }}_{(aq)}\) و \(.\,{A^{2 + }}_{(aq)}\)
8 با توجه به واکنش های زیر به طور طبیعی انجام می شوند گونه های کاهنده و گونه های اکسنده را بر حسب کاهش قدرت مرتب کنید؟
\(\begin{array}{l}2C{r^{2 + }}(aq) + S{n^{2 + }}(aq) \to 3C{r^{3 + }}(aq) + Sn(s)\\\\Fe(s) + 2C{r^{3 + }}(aq) \to F{e^{2 + }}(aq) + 2C{r^{2 + }}(aq)\end{array}\)

9 با توجه به جدول پتانسیل های کاهشی استاندارد توضیح دهید محلول هیدروکلریک اسید را در کدام ظرف (مسی یا آهنی) می توان نگه داشت؟
\({E^0}_{(SHE)} = 0\,V\) ؛ از آن جا که این محلول حاوی یون های \({H^ + }_{(aq)}\) است که پتانسیل کاهشی این گونه نیز برابر صفر است و با توجه به جایگاه مس و آهن در جدول کاهشی و منفی بودن این عدد برای آهن می توان نتیجه گرفت آهن بر خلاف مس در مجاورت محلول اسید واکنش می دهد. به عبارتی ظرف آهنی دچار خوردگی می شود اما ظرف مسی واکنشی با محلول هیدرو کلریک اسید نمی دهد:
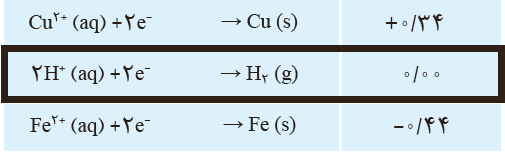
10 به قدرمطلق پتانسيل كاهشی استاندارد دو نیم سلول زير توجه کنید. هنگامی که اين دو نيم سلول را به هم وصل می كنيم، جريان الكتریكی از نیم سلول X به نیم سلول Y برقرار می شود اما با اتصال نيم سلول X به SHE، الكترون ها از نيم سلول X به سمت SHE جاری می شوند. نيروی الكتروموتوری سلول گالوانی از اين دو نيم سلول را حساب كنيد.
\(\begin{array}{l}{Y^{2 + }} + 2{e^ - } \to Y\,\,\,\,\,\,\,\,\,\,\,\left| {{E^0}} \right| = 0/34\,V\\\\{X^{2 + }} + 2{e^ - } \to X\,\,\,\,\,\,\,\,\,\,\,\left| {{E^0}} \right| = 0/25\,V\end{array}\)
مرحله ۱: تعیین علامت پتانسیلها
الف نیم سلول X:
مسئله میگوید وقتی نیمسلول X به SHE (نیمسلول استاندارد هیدروژن) متصل میشود، الکترونها از X به سمت SHE جاری میشوند.
در یک سلول گالوانی، الکترونها همیشه از آند (قطب با پتانسیل کاهشی پایینتر) به کاتد (قطب با پتانسیل کاهشی بالاتر) حرکت میکنند.
چون پتانسیل استاندارد SHE برابر با صفر ولت است \(({E^ \circ }_{SHE} = 0\,V)\) و X نقش آند را دارد، پس پتانسیل آن باید از صفر کمتر باشد.
بنابراین، \({E^ \circ }\) برای نیم سلول X منفی است:
\(E_X^ \circ = - 0/25\,V\)
ب نیم سلول Y:
مسئله میگوید وقتی نیمسلولهای X و Y به هم وصل میشوند، جریان الکتریکی از X به Y برقرار میشود.
این یعنی در این سلول، X آند و Y کاتد است.
در نتیجه، پتانسیل کاهشی Y باید از پتانسیل کاهشی X بزرگتر باشد \(.\,(E_Y^ \circ > E_X^ \circ )\)
با توجه به اینکه \(\left| {E_Y^ \circ } \right| = 0/34\,V\) و \(E_X^ \circ = - 0/25\,V\) تنها مقداری که شرط \(E_Y^ \circ > - 0/25\,V\) را برآورده میکند، مقدار مثبت است.
بنابراین، \({E^ \circ }\) برای نیم سلول Y مثبت است:
\(E_Y^ \circ = + 0/34\,V\)
مرحله ۲: محاسبه نیروی الکتروموتوری (EMF)
حالا که پتانسیلهای استاندارد هر دو نیمسلول را داریم، میتوانیم EMF سلول را با استفاده از فرمول زیر محاسبه کنیم:
\(E_{cell}^ \circ = E_{Cathode}^ \circ - E_{Anode}^ \circ \)
کاتد (قطب مثبت): نیم سلول Y با \(E_Y^ \circ = + 0/34\,V\)
آند (قطب منفی): نیم سلول X با \(E_X^ \circ = - 0/25\,V\)
\(E_{cell}^ \circ = ( + 0/34\,V) - ( - 0/25\,V) = 0/59\,V\)
11 اگر کاتد نوعی باتری لیتیمی که در تلفن همراه به کار می رود، حاوی \(Mn{O_2}(s)\) باشد؛ نیم واکنش ها به شکل زیر خواهند بود:
\(\begin{array}{l}Li(s) \to L{i^ + }(s) + e\\\\Mn{O_2}(s) + L{i^ + }(s) + e \to Li\,Mn{O_2}(s)\end{array}\)
آ عدد اکسایش Mn را در \(Mn{O_2}(s)\) و \(Li\,Mn{O_2}(s)\) تعیین کنید.
ب هنگامی که تلفن یا رایانه همراه روشن است و باتری نقش سلول گالوانی را دارد، چگونگی جابه جایی الکترون ها و یون های لیتیم را توصیف کنید.
پ هنگامی که تلفن یا رایانه همراه در حال شارژ شدن است و باتری نقش سلول الکترولیتی را دارد، چگونگی جابه جایی الکترون ها و یون های لیتیم را توصیف کنید.
آ تعیین عدد اکسایش منگنز (Mn)
برای پیدا کردن عدد اکسایش، از این قاعدهٔ کلیدی استفاده میکنیم که مجموع اعداد اکسایش در یک ترکیب خنثی، برابر با صفر است.
در ترکیب \(:\,Mn{O_2}\)
1 عدد اکسایش اکسیژن (O) معمولاً ۲- است.
2 چون دو اتم اکسیژن داریم، مجموع بار آنها 2 × (-2) = -4 میشود.
3 برای اینکه کل ترکیب خنثی (صفر) باشد، عدد اکسایش منگنز (Mn) باید ۴+ باشد.
(+4) + (-4) = 0
4 با حل این معادله ساده، عدد اکسایش منگنز (Mn) برابر با ۳+ به دست میآید.
نتیجه: عدد اکسایش منگنز از ۴+ به ۳+ کاهش یافته است، که نشاندهندهٔ نیمواکنش کاهش در کاتد است.
ب هنگام کار کردن باتری (تخلیه یا Discharge)
وقتی تلفن همراهت روشن است، باتری مانند یک سلول گالوانی عمل کرده و انرژی الکتریکی تولید میکند.
جریان الکترونها: الکترونها در آند (الکترود لیتیم) تولید میشوند و از طریق مدارهای داخلی تلفن همراه (مدار بیرونی) به سمت کاتد (الکترود \(Mn{O_2}\)) حرکت میکنند تا در آنجا مصرف شوند. این جریان الکترون است که به دستگاه تو انرژی میدهد.
جریان یونهای لیتیم \(:\,(L{i^ + })\) همزمان، یونهای لیتیم \((L{i^ + })\) که در آند به وجود آمدهاند، از طریق محلول الکترولیت از سمت آند به سمت کاتد حرکت میکنند تا در واکنش کاهش شرکت کنند.
پ هنگام شارژ شدن باتری (Charge)
وقتی تلفن را به شارژر وصل میکنی، باتری مانند یک سلول الکترولیتی عمل میکند و شارژر با اعمال ولتاژ، واکنشها را در جهت عکس انجام میدهد.
جریان الکترونها: شارژر، الکترونها را از الکترود \(Mn{O_2}\) (که حالا نقش آند را دارد) میگیرد و آنها را از طریق سیم شارژر به سمت الکترود لیتیم (که حالا نقش کاتد را دارد) هدایت میکند.
جریان یونهای لیتیم \(:\,(L{i^ + })\) یونهای لیتیم \((L{i^ + })\) از الکترود \(Mn{O_2}\) جدا شده و از طریق محلول الکترولیت به سمت الکترود دیگر حرکت میکنند تا در آنجا با گرفتن الکترون، دوباره به اتم لیتیم تبدیل شده و باتری برای استفادهٔ مجدد آماده شود.
این فرایند دقیقاً در شکل زیر نمایش داده شده است:
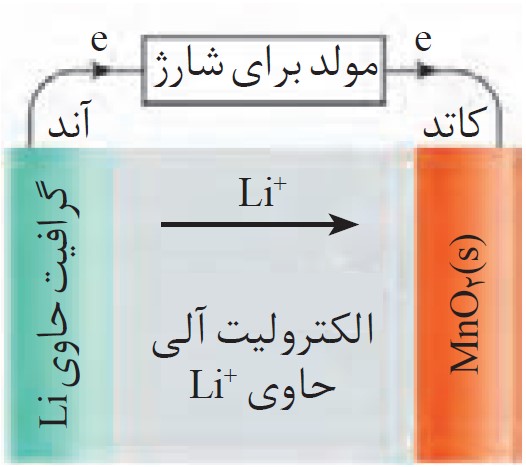
12 شیمی دان ها در برخی سلول های الکتروشیمیایی برای انجام واکنش اکسایش-کاهش از نور بهره می برند و آنها را سلول نور الکتروشیمیایی می نامند.
در نمونه ای از آنها که برای تهیه گاز هیدروژن از آب به کار می رود، با توجه به نیم واکنش های زیر:
\(\begin{array}{l}Si{O_2}(s) + 4\,H_{}^ + (aq) + 4\,e\;\; \to Si(s) + 2\,{H_2}O(l)\quad ,\quad {E^ \circ } = - 0/84\,V\\\\2\,{H_2}O(l) + 2\,e \to {H_2}(g) + 2O\,H_{}^ - (aq)\begin{array}{*{20}{c}}{}&{}&{}&{}\end{array},\;\;{\kern 1pt} {\kern 1pt} {E^ \circ } = - 0/83\,V\end{array}\)
آ نیم سلول آند و کاتد را مشخص و emf سلول را حساب کنید.
ب یافته های تجربی نشان می دهند که افزون بر emf، بازده و سرعت انجام واکنش در این سلول پایین است، با این توصیف چرا برخی استفاده از آنها را برای تهیه گاز هیدروژن مناسب می دانند؟

آ
نیم سلول آندی:
\(Si{O_2}_{(s)} + 4\,H_{(aq)}^ + + 4\,e\;\; \to S{i_{(s)}} + 2\,{H_2}{O_{(l)}}\quad ,\quad {E^ \circ } = - 0/84\,V\)
نیم سلول کاتدی:
\(\begin{array}{l}2\,{H_2}{O_{(l)}} + 2\,e \to {H_2}_{(g)} + 2O\,H_{(aq)}^ - \begin{array}{*{20}{c}}{}&{}&{}&{}\end{array}\;\;{\kern 1pt} {\kern 1pt} {E^ \circ } = - 0/83\,V\\\\ \Rightarrow {E_{Cell}} = {E_{cathode}} - {E_{anode}} = - 0/83 - ( - 0/84) = 0/01\,V\end{array}\)
ب
1 تولید گاز H2 برای سلول خورشیدی
2 استفاده از انرژی پاک خورشید
3 انرژی رایگان خورشید
13 در یک آزمایش چهار فلز A ، B ، C و D رفتارهای زیر را نشان داده اند:
فقط فلزهای A و C با محلول 0/1 مولار هیدروکلریک اسید واکنش می دهند و گاز هیدروژن تولید می کنند.
با قرار دادن فلز C در محلول های حاوی یون های \({A^{2 + }}\,,\,{B^{2 + }}\,,\,{D^{2 + }}\) به ترتیب فلزهای D، B و A رسوب می کنند.
یون \({B^{2 + }}(aq)\) اکسنده قوی تری از \({D^{2 + }}(aq)\) است.
بر اساس دادههای آزمایش، ترتیب کاهندگی این چهار فلز از قوی به ضعیف به صورت زیر است:
C > A > D > B
چگونه به این نتیجه رسیدیم؟ (تحلیل گام به گام)
برای رسیدن به پاسخ، هر کدام از سرنخها را جداگانه بررسی میکنیم:
سرنخ ۱: واکنش با اسید
داده: فقط فلزهای A و C با هیدروکلریک اسید واکنش میدهند و گاز هیدروژن \(({H_2})\) تولید میکنند.
اصل کلیدی: فلزی میتواند با اسید واکنش دهد و \({H_2}\) آزاد کند که کاهندهتر از هیدروژن باشد (یعنی پتانسیل کاهشی منفی داشته باشد).
نتیجهگیری:
- قدرت کاهندگی A و C از هیدروژن بیشتر است.
- قدرت کاهندگی B و D از هیدروژن کمتر است.
- بنابراین، دو فلز قویتر ما A و C هستند و دو فلز ضعیفتر، B و D.
سرنخ ۲: واکنش فلز C با یونهای دیگر
داده: فلز C، یونهای فلزهای A، B و D را از محلولِ شان خارج کرده و به شکل فلز جامد رسوب میدهد.
اصل کلیدی: یک فلز کاهنده، تنها میتواند یونهای فلزی را کاهش دهد (رسوب دهد) که از خودش کاهندهٔ ضعیفتری باشد.
نتیجهگیری:
- فلز C از هر سه فلز دیگر کاهندهتر است.
- با این سرنخ، قویترین کاهنده را پیدا کردیم: فلز C .
سرنخ ۳: مقایسه قدرت اکسندگی یونها
داده: یون \({B^{2 + }}\) اکسندهٔ قویتری از یون \({D^{2 + }}\) است.
اصل کلیدی: قدرت اکسندگی یون یک فلز، با قدرت کاهندگی خود آن فلز رابطهٔ عکس دارد. یعنی هرچه یون یک فلز اکسندهتر باشد، خود فلز کاهندهتر است.
نتیجهگیری:
چون یون \({B^{2 + }}\) اکسنده تر از یون \({D^{2 + }}\) است، پس فلز D کاهندهتر از فلز B است.
D > B
جمعبندی نهایی
حالا تمام قطعات پازل را کنار هم میگذاریم:
از سرنخ ۲ فهمیدیم که C از همه قویتر است.
از سرنخ ۱ فهمیدیم که A و C قویتر از B و D هستند. پس A در رتبه دوم قرار میگیرد.
از سرنخ ۳ فهمیدیم که بین دو فلز ضعیفتر، D از B قویتر است.
بنابراین، ترتیب نهایی قدرت کاهندگی به این صورت مشخص میشود: C > A > D > B
14 جدول روبه رو نيروی الكتروموتوری سه سلول گالوانی را نشان می دهد؛ اگر \({E^ \circ }\,({C^{2 + }}/C) = - 0/14\,V\) و در این سلول ها، نیم سلول کاتد باشد:
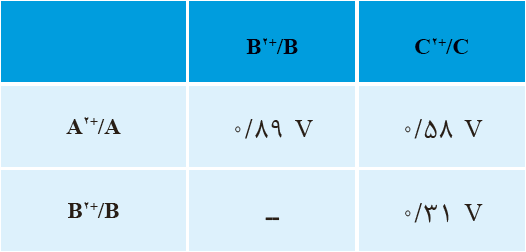
آ پتانسیل کاهشی استاندارد را برای دو نیم سلول \({A^{2 + }}/A\) و \({B^{2 + }}/B\) به دست آورید.
ب نماد شیمیایی اکسنده ترین و کاهنده ترین گونه را بنویسید.
آ محاسبه پتانسیل کاهشی استاندارد
با استفاده از اطلاعات داده شده، پتانسیلهای کاهشی استاندارد \(({E^ \circ })\) برای نیمسلولهای A و B به صورت زیر محاسبه میشوند:
پتانسیل نیم سلول A:
در سلول گالوانی A-C، نیروی الکتروموتوری (emf) برابر با ۰/۳۰ ولت است و نیمسلول C کاتد است.
با استفاده از فرمول \(E_{cell}^ \circ = E_{Cathode}^ \circ - E_{Anode}^ \circ \) داریم:
\(\begin{array}{l}0/30\,V = {E^ \circ }({C^{2 + }}/C) - {E^ \circ }({A^{2 + }}/A)\\\\ \Rightarrow 0/30\,V = ( - 0/84\,V) - {E^ \circ }({A^{2 + }}/A)\\\\ \Rightarrow {E^ \circ }({A^{2 + }}/A) = - 0/84\,V - 0/30\,V = - 1/14\,V\end{array}\)
پتانسیل نیم سلول B :
در سلول گالوانی B-C، نیروی الکتروموتوری برابر با 1/04 ولت است و نیمسلول C کاتد است.
با استفاده از همان فرمول داریم:
\(\begin{array}{l}1/04\,V = {E^ \circ }({C^{2 + }}/C) - {E^ \circ }({B^{2 + }}/B)\\\\ \Rightarrow 1/04\,V = ( - 0/84\,V) - {E^ \circ }({B^{2 + }}/B)\\\\ \Rightarrow {E^ \circ }({B^{2 + }}/B) = - 0/84\,V - 1/04\,V = - 1/88\,V\end{array}\)
ب تعیین اکسندهترین و کاهندهترین گونه
برای تعیین قویترین اکسنده و کاهنده، پتانسیلهای کاهشی استاندارد سه نیمسلول را مقایسه میکنیم:
\(\begin{array}{l}{E^ \circ }({C^{2 + }}/C) = - 0/84\,V\\\\{E^ \circ }({A^{2 + }}/A) = - 1/14\,V\\\\{E^ \circ }({B^{2 + }}/B) = - 1/88\,V\end{array}\)
اکسندهترین گونه: گونهای است که بیشترین تمایل را برای کاهش یافتن دارد، یعنی دارای بالاترین (منفیترینِ کمتر) پتانسیل کاهشی است. در میان یونهای \({C^{2 + }}\,,\,{B^{2 + }}\,,\,{A^{2 + }}\) ، یون \({C^{2 + }}\) با پتانسیل \({E^ \circ } = - 0/84\,V\) قویترین اکسنده است.
کاهندهترین گونه: گونهای است که بیشترین تمایل را برای اکسید شدن دارد، یعنی دارای پایینترین (منفیترینِ بیشتر) پتانسیل کاهشی است. در میان فلزهای A، B و C، فلز B با پتانسیل \({E^ \circ } = - 1/88\,V\) قویترین کاهنده است.
15 با توجه به شکل به پرسش ها پاسخ دهید.
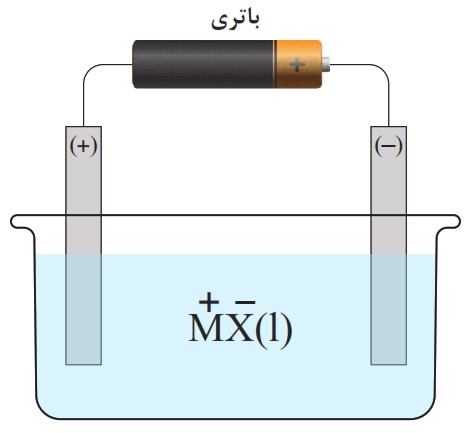
آ این سلول گالوانی است یا الکترولیتی؟ چرا؟
ب در سطح کدام الکترود، نیم واکنش اکسایش رخ می دهد؟ چرا؟
پ در سطح کدام الکترود، اتم های M پدید می آیند؟ چرا؟
ت در سطح کدام الکترود از یون ها، الکترون آزاد می شود؟
آ
این سلول یک سلول الکترولیتی است؛ زیرا برای انجام واکنش شیمیایی از یک منبع انرژی خارجی (یک باتری) استفاده میکند. سلولهای الکترولیتی انرژی الکتریکی را مصرف میکنند تا یک واکنش غیر خودبهخودی را به انجام برسانند، در حالی که سلولهای گالوانی خودشان انرژی الکتریکی تولید میکنند.
ب
نیمواکنش اکسایش در سطح الکترود مثبت (+) رخ میدهد؛ در یک سلول الکترولیتی، الکترود مثبت، آند نامیده میشود. یونهای منفی (آنیون ها یا \(({X^ - }\) به سمت این الکترود جذب میشوند و با از دست دادن الکترون، اکسید میشوند. اکسایش به معنای از دست دادن الکترون است.
پ
اتمهای M در سطح الکترود منفی (-) پدید میآیند؛ الکترود منفی، کاتد نامیده میشود. یونهای مثبت (کاتیونها یا \(({M^ + }\) به سمت این الکترود کشیده میشوند و در آنجا با گرفتن الکترون، کاهش یافته و به اتمهای خنثی M تبدیل میشوند.
ت
الکترون از یونها در سطح الکترود مثبت (+) آزاد میشود؛ آزاد شدن الکترون همان فرایند اکسایش است. همانطور که در قسمت (ب) توضیح داده شد، یونهای منفی \({X^ - }\) در الکترود مثبت الکترونهای خود را از دست میدهند (آزاد میکنند).
16 می دانید که برای استفاده از هر سلول الکترولیتی به یک مولد یا باتری (سلول گالوانی) نیاز است، شکل روبه رو این ویژگی را نشان می دهد.
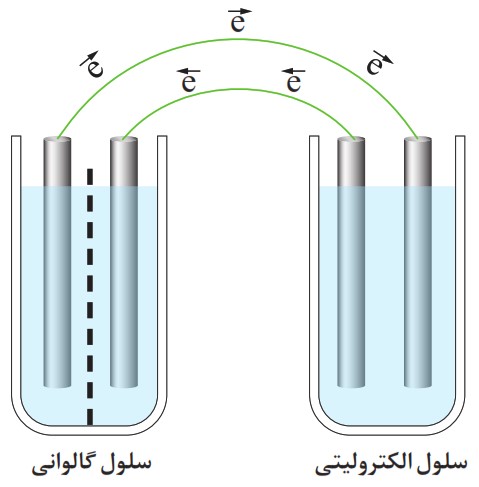
نخست آند و کاتد را برای هر الکترود در هر سلول مشخص کنید، سپس روند انجام فرایند جابه جایی الکترون ها را هنگام استفاده از یک سلول الکترولیتی توضیح دهید.
۱ تعیین آند و کاتد
برای تشخیص آند و کاتد، همیشه به فرآیند اکسایش (از دست دادن الکترون) و کاهش (گرفتن الکترون) توجه میکنیم.
سلول گالوانی (باتری - سمت چپ):
- آند (قطب منفی): الکترودی که در آن اکسایش رخ میدهد و الکترون تولید میکند (الکترود سمت چپ در شکل).
- کاتد (قطب مثبت): الکترودی که در آن کاهش رخ میدهد و الکترونها را مصرف میکند (الکترود سمت راست در شکل).
سلول الکترولیتی (سمت راست):
- کاتد (قطب منفی): این الکترود به قطب منفی باتری وصل است، الکترون دریافت میکند و در آن کاهش رخ میدهد (الکترود سمت چپ).
- آند (قطب مثبت): این الکترود به قطب مثبت باتری وصل است، الکترون از دست میدهد و در آن اکسایش رخ میدهد (الکترود سمت راست).
۲ روند جابهجایی الکترونها
روند جابجایی الکترون در این سیستم مانند یک مدار الکتریکی عمل میکند که در آن سلول گالوانی نقش منبع تغذیه یا پمپ الکترون را ایفا میکند.
الف تولید الکترون: در سلول گالوانی، یک واکنش شیمیایی خودبهخودی اتفاق میافتد. در آند این سلول، اکسایش رخ داده و الکترونها آزاد میشوند.
ب پمپاژ الکترون: این الکترونها از طریق سیم به کاتد سلول الکترولیتی منتقل میشوند. در واقع، باتری الکترونها را به این الکترود «پمپ» میکند.
پ کشش الکترون: همزمان، قطب مثبت باتری (کاتد سلول گالوانی) الکترونها را از آند سلول الکترولیتی به سمت خود میکشد.
ت انجام واکنش غیر خودبهخودی: این جریان اجباری الکترون که توسط باتری ایجاد شده، باعث میشود در سلول الکترولیتی یک واکنش شیمیایی غیر خودبهخودی انجام شود:
- یونهای مثبت در محلول به سمت کاتد (قطب منفی) حرکت کرده و با گرفتن الکترون، کاهش مییابند.
- یونهای منفی در محلول به سمت آند (قطب مثبت) حرکت کرده و با از دست دادن الکترون، اکسایش مییابند.
به طور خلاصه، سلول گالوانی انرژی شیمیایی را به انرژی الکتریکی تبدیل میکند تا سلول الکترولیتی بتواند انرژی الکتریکی را مصرف کرده و یک واکنش شیمیایی دلخواه را به انجام برساند.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه چهارم تا دوازدهم- آزمون آنلاین تمامی دروس
- گام به گام تمامی دروس
- ویدئو های آموزشی تمامی دروس
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس
- فلش کارت های آماده دروس
- گنجینه ای جامع از انشاء های آماده
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه



1736019749.png)















