جواب تمرین های دوره ای صفحه 96 درس 2 شیمی یازدهم (در پی غذای سالم)
تعداد بازدید : 84.73Mپاسخ تمرین های دوره ای صفحه 96 شیمی یازدهم
-گام به گام تمرین های دوره ای صفحه 96 درس در پی غذای سالم
-تمرین های دوره ای صفحه 96 درس 2
-شما در حال مشاهده جواب تمرین های دوره ای صفحه 96 شیمی یازدهم هستید. ما در تیم مای درس، پاسخنامههای کاملاً تشریحی و استاندارد را مطابق با آخرین تغییرات کتاب درسی 1404 برای شما گردآوری کردهایم. اگر به دنبال بهروزترین پاسخها برای این صفحه هستید و میخواهید بدون نیاز به اتصال به اینترنت، علاوه بر پاسخهای گام به گام، به گنجینهای از مطالب درسی دسترسی پیدا کنید، حتماً اپلیکیشن مایدرس را نصب نمایید.
📥 دانلود اپلیکیشن مایدرس
برای دسترسی آفلاین، سریع و بدون نیاز به اینترنت به گنجینهای از گامبهگامها و نمونه سوالات، اپلیکیشن را نصب کنید.
1) اغلب ورزشکاران برای درمان آسیب دیدگی های خود از بسته هایی استفاده می کنند که به سرعت گرما را انتقال می دهند. اساس کار این بسته ها، انحلال برخی ترکیب های یونی در آب است. با توجه به معادله های ترموشیمیایی زیر به پرسش های مطرح شده پاسخ دهید:
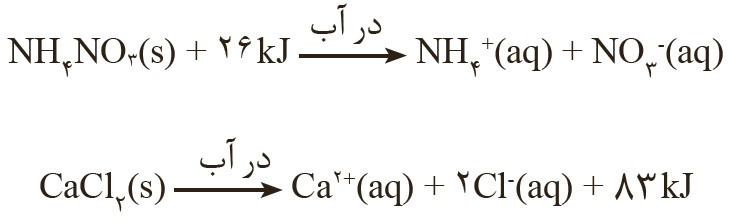
الف) کدام فرایند انحلال برای سرد کردن محل آسیب دیدگی مناسب است؟ چرا؟
ب) از انحلال کامل 2/22g کلسیم کلرید خشک درآب چند کیلوژول گرما آزاد می شود؟
2) چربی ذخیره شده در کوهان شتر هنگام اکسایش افزون بر آب مورد نیاز، انرژی لازم برای فعالیت های جانور را نیز تأمین می کند. واکنش ترموشیمیایی آن به صورت زیر است:
2 C57H110O6 (aq) + 163 O2 (g) → 114 CO2 (g) + 110 H2O (l)
∆H = -75520 kJ
حساب کنید از اکسایش هر کیلوگرم چربی، چند کیلوژول انرژی آزاد می شود؟
3) کلسترول، یکی از مواد آلی موجود در غذاهای جانوری است که مقدار اضافی آن در دیوارۀ رگ ها رسوب می کند، فرایندی که منجر به گرفتگی رگ ها و سکته می شود. با توجه به ساختار آن به پرسش های مطرح شده پاسخ دهید.

الف) توضیح دهید چرا شیمی دان ها آن را یک الکل سیر نشده می دانند؟
ب) با توجه به جدول شمارۀ 3، در شرایط یکسان کدام پیوندهای اشتراکی یگانه در ساختار کلسترول آسان تر می شود؟ چرا؟
4) از مصرف هر گرم آلومینیم در واکنش ترمیت، kJ 15/24 گرما آزاد می شود.
2 Al (s) + Fe2O3 (s) → 2 Al2O3 (s) + 2Fe (l)
الف) این مقدار گرما، دمای صدگرم آب خالص را چند درجۀ سلسیوس افزایش می دهد؟
ب) آنتالپی واکنش ترمیت را حساب کنید.
بر اساس معادله موازنه شده، دو مول آلومینیوم به مصرف می رسد، بنابراین :
و چون گرما آزاد می شود :
5) با توجه به واکنش ترموشیمیایی:
H2 (g) + I2 (s) + 53 kJ → 2 HI (g)
آنتالپی واکنش
H2 (g) + I2 (g) → 2 HI (g)
را حساب کنید. راهنمایی : آنتالپی فرازش (تصعید) ید را در نظر بگیرید.
6) شکل زیر واکنش میان گاز هیدروژن و بخار بنفش رنگ ید را در دمای معینی نشان می دهد.
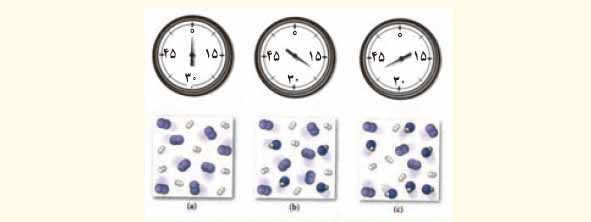
اگر هر ذره هم ارز با 0/1 مول از ماده و سامانه دو لیتری باشد، سرعت واکنش را پس از 20 دقیقه (b)و پس از 40 دقیقه (c) برحسب مول بر لیتر ساعت حساب و با یکدیگر مقایسه کنید.
7) ΔH واکنش
C2H4 (g) + H2 (g) → C2H6 (g)
را با استفاده از :
الف) جدول 2 و 3 حساب کنید.
ب) آنتالپی سوختن اتن، اتان و هیدروژن که به ترتیب برابر با 1410- ، 1560- و 286- کیلوژول بر مول است، حساب کنید.
پ) ΔH محاسبه شده از کدام قسمت را برای یک گزارش علمی انتخاب می کنید؟ توضیح دهید.
8) با توجه به جدول زیر به پرسش های مطرح شده پاسخ دهید.
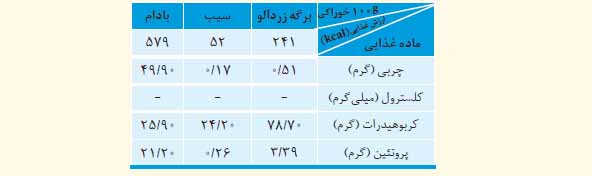
الف) اگر بدن فردی نیاز فوری و ضروری به تأمین انرژی داشته باشد، کدام خوراکی را پیشنهاد می کنید؟ چرا؟
ب) مصرف کدام خوراکی را برای فعالیت های فیزیکی که در مدت طولانی تری انجام می شوند، مناسب می دانید؟ توضیح دهید.
پ) اگر یک فرد 70 کیلوگرمی، 25 گرم بادام خورده باشد، برای مصرف انرژی حاصل از آن چه مدت باید پیاده روی کند؟
آهنگ مصرف انرژی در پیاده روی را 190 کیلو کالری بر ساعت در نظر بگیرید.
9) با توجه به اطلاعات داده شده، آنتالپی واكنش زیر را حساب كنيد.
\(\begin{array}{l}Fe{O_{(s)}} + C{O_{(g)}} \to F{e_{(s)}} + C{O_2}_{(g)}\,\,\,\,\Delta H = ?\\\\\\F{e_2}{O_3}_{(s)} + 3C{O_{(g)}} \to 2F{e_{(s)}} + 3C{O_2}_{(g)}\,\,\,\,\Delta {H_1} = - 23\\\\3F{e_2}{O_3}_{(s)} + C{O_{(g)}} \to 2F{e_3}{O_4}_{(s)} + C{O_2}(g)\,\,\,\,\Delta {H_2} = - 39\\\\F{e_3}{O_4}_{(s)} + C{O_{(g)}} \to 3Fe{O_{(s)}} + C{O_2}_{(g)}\,\,\,\,\Delta {H_3} = + 18\end{array}\)
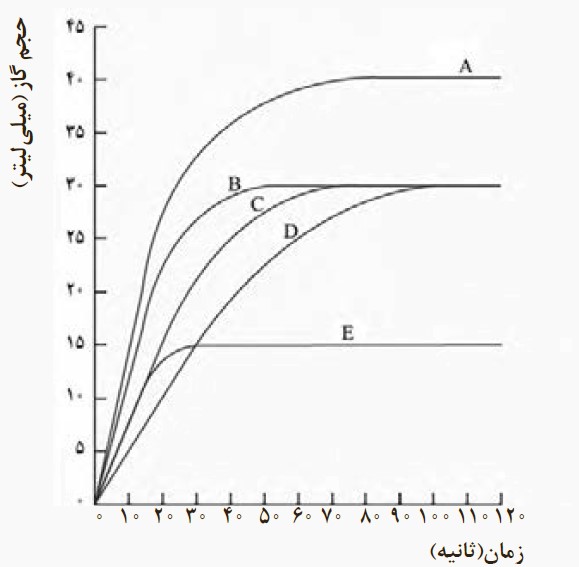
10) در نمودار زیر، منحنی C مربوط به واکنش 0/5 گرم نوار منیزیم با مقدار کافی از هیدروکلریک اسید در دمای اتاق است.منحنی های دیگر مربوط به همین واکنش اما در شرایط متفاوتی است. با توجه به آنها به پرسش ها پاسخ دهید.
1) الف) انحلال آمونیوم نیترات در آب، زیرا این فرایند گرماگیر بوده و دمای محلول را پایین می آورد.
ب)
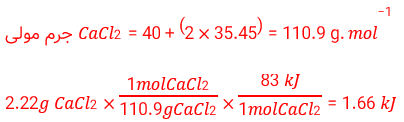
1/66 کیلو ژول گرما آزاد می شود.
2)
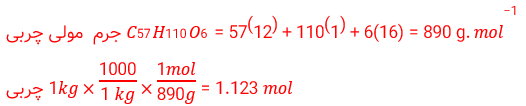
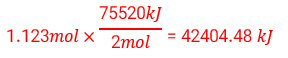
42404/48 کیلوژول گرما آزاد می شود.
3) الف) زیرا این ساختار دارای یک گروه هیدروکسیل و یک پیوند دوگانه می باشد.
ب) در ساختار کلسترول، پیوندهای یگانه به صورت زیر می باشد:
[C-O , C-C , C-H , O-H]
که به ترتیب از راست به چپ، دارای آنتالپی های پیوند 463، 413، 348، 380 کیلوژول بر مول می باشند. بنابراین پیوند C-C راحت تر شکسته می شود.
4) الف)

ب)

5)
H2 (g) + I2 (g) → 2HI (g) ∆H = ? kJ
H2 (g) + I2 (s) → 2HI (g) ∆H1 = 53 kJ بدون تغییر (نوران)
I2 (s) → I2 (g) ∆H2 = 63/5 kJ
H2 (g) + I2 (s) → 2HI (g) ∆H1 = 53 kJ
I2 (s) → I2 (g) ∆H2 = 63/5 kJ
H2 (g) + I2 (s) → HI (g) ∆H = ∆H1 + ∆H2 = 53 - 62/5 = -9/5 kJ
6) از آنجا که زمان بر حسب min داده و بر حسب h خواسته شده است، بنابراین min را به h تبدیل کنیم:
H2 (g) + I2 (s) → 2HI (g)
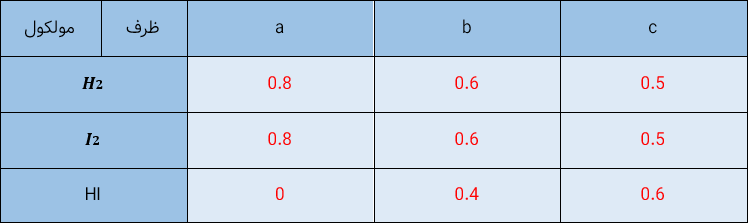
سرعت واکنش در بازه (0 تا 20 دقیقه) :
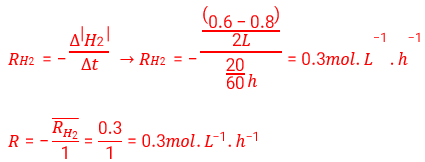
سرعت واکنش در بازه (0 تا 40 دقیقه) :
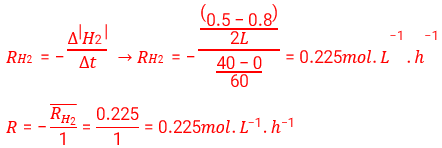
7) الف)
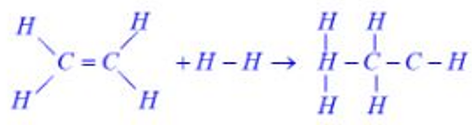
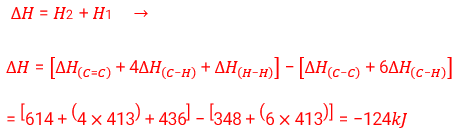
ب)
∆H = H2 + H1 → ∆H = [-1560] – [-1410 + (-286)] = +136 kJ
پ) قسمت الف با استفاده از آنتالپی پیوند، زیرا مقادیر ارائه شده در قسمت ب آنتالپی سوختن هست که می بایستی آنتالپی استاندارد تشکیل این مواد به جای آنتالپی سوختن ذکر شود.
8) الف) برگه زردآلو، زیرا کربوهیدرات بیشتری داشته و این ماده سریع تر جذب بدن می شود و تولید انرژی می کند.
ب) بادام، زیرا با توجه به مقدار ارزش غذایی ارائه شده، انرژی بیشتری آزاد می کند.
پ) حدود 45 دقیقه باید پیاده روی کند.
9)
\(\begin{array}{l}Fe{O_{(s)}} + C{O_{(g)}} \to F{e_{(s)}} + C{O_2}_{(g)}\,\,\,\,\,(A)\,\\\\\\F{e_2}{O_3}_{(s)} + 3C{O_{(g)}} \to 2F{e_{(s)}} + 3C{O_2}_{(g)}\,\,\,\,\,(B)\\\\3F{e_2}{O_3}_{(s)} + C{O_{(g)}} \to 2F{e_3}{O_4}_{(s)} + C{O_2}_{(g)}\,\,\,\,\,(C)\\\\\underline {F{e_3}{O_4}_{(s)} + C{O_{(g)}} \to 3Fe{O_{(s)}} + C{O_2}_{(g)}\,\,\,\,\,(D)} \\\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \downarrow \\3Fe{O_{(s)}} + C{O_2}_{(g)} \to F{e_3}{O_4}_{(s)} + C{O_{(g)}}\,\,\,\,\,( - D)\\\\2F{e_3}{O_4}_{(s)} + C{O_2}_{(g)} \to 3F{e_2}{O_3}_{(s)} + C{O_{(g)}}\,\,\,\,\,( - C)\\\\\underline {F{e_2}{O_3}_{(s)} + 3C{O_{(g)}} \to 2F{e_{(s)}} + 3C{O_2}_{(g)}\,\,\,\,\,(B)} \\\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \downarrow \\6Fe{O_{(s)}} + 2C{O_2}_{(g)} \to 2F{e_3}{O_4}_{(s)} + 2C{O_{(g)}}\,\,\,\,\,( - 2D)\\\\2F{e_3}{O_4}_{(s)} + C{O_2}_{(g)} \to 3F{e_2}{O_3}_{(s)} + C{O_{(g)}}\,\,\,\,\,( - C)\\\\\underline {3F{e_2}{O_3}_{(s)} + 9C{O_{(g)}} \to 6F{e_{(s)}} + 9C{O_2}_{(g)}\,\,\,\,\,(3B)} \\\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, + \\\\6Fe{O_{(s)}} + 6C{O_{(g)}} \to 6F{e_{(s)}} + 6C{O_2}_{(g)}\,\,\,\,\,(6A)\,\\\\ \Rightarrow 6A = 3B - C - 2D \Rightarrow A = \frac{1}{2}B - \frac{1}{6}C - \frac{1}{3}D\\\\ \Rightarrow \Delta H = \frac{1}{2}\Delta {H_1} - \frac{1}{6}\Delta {H_2} - \frac{1}{3}\Delta {H_3}\\\\ \Rightarrow \Delta H = \frac{1}{2}( - 23) - \frac{1}{6}( - 39) - \frac{1}{3}(18)\\\\\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, = \frac{{ - 69 + 39 - 36}}{6} = - 11kJ\end{array}\)
10) الف)
C سرعت واکنش \( = \frac{{(30 - 0)ml}}{{(60 - 0)s}} \times \frac{{1L}}{{1000ml}} \times \frac{{3600s}}{{1h}} = \frac{{3 \times 3600}}{{6 \times 1000}} = 1/8\frac{L}{h}\)
D سرعت واکنش \( = \frac{{(30 - 0)ml}}{{(90 - 0)s}} \times \frac{{1L}}{{1000ml}} \times \frac{{3600s}}{{1h}} = \frac{{3 \times 3600}}{{9 \times 1000}} = 1/2\frac{L}{h}\)
ب) واکنش A؛ به این دلیل که در حالت پودر بودن، اتم های واکنش دهنده در تماس بیشتری با یکدیگر هستند و بنابراین سرعت واکنش بیشتر می شود، ولی در حالت نوار بودن، ابتدا اتم های روی روکش نوار باید واکنش دهند تا تماس با اتم های دیگر واکنش دهنده منیزیم اتفاق بیفتد و این خود نیز زمان بر می باشد و سرعت واکنش کمتر از حالت پودری می شود.
پ) واکنش E؛ زیرا هر چه دمای پایین باشد، سرعت حرکت اتم های واکنش دهنده کمتر می باشد و برای تماس بین اتم های واکنش دهنده زمان بیشتری نیاز می باشد و واکنش با سرعت کمتری اتفاق می افتد. همچنین به این دلیل که برای سرعت بخشیدن به واکنش نیاز به انرژی بیشتری می باشد و در دمای پایین، انرژی واکنش دهنده ها کمتر می باشد، انرژی بوجود آمده بعد از ترکیب واکنش دهنده ها صرف گرم کردن و انرژی دادن به اتم های واکنش دهنده دیگر می شود تا واکنش صورت پذیرد که این خود باعث می شود سرعت واکنش در دمای پایین، کمتر شود.
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه چهارم تا دوازدهم- آزمون آنلاین تمامی دروس
- گام به گام تمامی دروس
- ویدئو های آموزشی تمامی دروس
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس
- فلش کارت های آماده دروس
- گنجینه ای جامع از انشاء های آماده
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه



1736019749.png)















