جواب خودرابیازمایید صفحه 76 درس 2 شیمی یازدهم (در پی غذای سالم)
تعداد بازدید : 84.72Mپاسخ خودرابیازمایید صفحه 76 شیمی یازدهم
-گام به گام خودرابیازمایید صفحه 76 درس در پی غذای سالم
-خودرابیازمایید صفحه 76 درس 2
-شما در حال مشاهده جواب خودرابیازمایید صفحه 76 شیمی یازدهم هستید. ما در تیم مای درس، پاسخنامههای کاملاً تشریحی و استاندارد را مطابق با آخرین تغییرات کتاب درسی 1404 برای شما گردآوری کردهایم. اگر به دنبال بهروزترین پاسخها برای این صفحه هستید و میخواهید بدون نیاز به اتصال به اینترنت، علاوه بر پاسخهای گام به گام، به گنجینهای از مطالب درسی دسترسی پیدا کنید، حتماً اپلیکیشن مایدرس را نصب نمایید.
📥 دانلود اپلیکیشن مایدرس
برای دسترسی آفلاین، سریع و بدون نیاز به اینترنت به گنجینهای از گامبهگامها و نمونه سوالات، اپلیکیشن را نصب کنید.
1) هیدروژن پراکسید (H2O2)ماده ای است که با نام تجاری آب اکسیژنه به فروش می رسد.
الف) با استفاده از واکنش های ترموشیمیایی زیر، آنتالپی واکنش را حساب کنید.
H2 (g) + O2 (g) → H2O2 (l)
H2 (g) + 1/2 O2 (g) → H2O (l) ∆H = -286 kJ
2H2O2 (l) → 2H2O (l) + O2 (g) ∆H = -196 kJ
ب) توضیح دهید چرا تهیه این ماده از واکنش مستقیم گازهای هیدروژن و اکسیژن ممکن نیست؟
2) در شیمی دهم آموختید که گازهای آلاینده مانند NOو CO از اگزوز خودروها به هواکره وارد می شوند. شیمی دان های هواکره انجام واکنش زیر را برای تبدیل این آلاینده ها به گازهایی پایدارتر و با آلایندگی کمتر، طراحی کرده اند.
2CO (g) + 2NO (g) → 2CO2 (g) + N2 (g) ∆H = ?
آنتالپی واکنش بالا را با استفاده از واکنش های ترموشیمیایی زیر حساب کنید.
CO (g) + 1/2 O2 (g) → CO2 (g) ∆H = -283 kJ
N2 (g) + O2 (g) → 2NO (g) ∆H = +181 kJ
3) واکنش سوختن کامل گرافیت را می توان مجموعه ای از دو واکنش پی در پی مطابق نمودار زیر دانست.
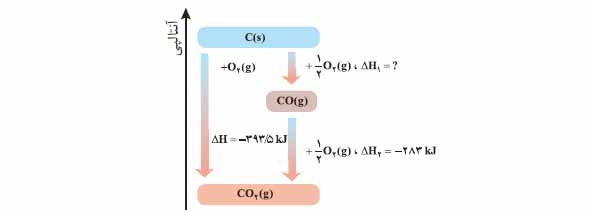
الف) شواهد نشان می دهد که ∆Hواکنش تولید CO (g)را نمی توان به روش تجربی تعیین کرد. دربارۀ علت آن گفت و گو کنید.
ب) ∆Hواکنش تولید CO (g)را از گرافیت و گاز اکسیژن حساب کنید.
4) شواهد تجربی نشان می دهند که تهیۀ آمونیاک به روش هابر از گازهای نیتروژن و هیدروژن مطابق نمودار زیر یک واکنش دو مرحله ای است.
الف) در شرایط یکسان، هیدرازین پایدارتر است یا آمونیاک؟ چرا؟
ب) آنتالپی واکنش تولید هیدرازین را حساب کنید.

1) الف) با توجه به قانون هس واکنش اول را می نویسیم و واکنش دوم را برعکس نموده و در 12 ضرب می کنیم.
H2 (g) + 1/2 O2 (g) → H2O (l) ∆H = -286 kJ
H2O (l) + 1/2 O2 (g) → H2O2 (l) ∆H = +196 kJ ÷ 2 = +88 kJ
در نتیجه داریم
H2 (g) + O2 (g) → H2O2 (l) ∆H = +196 kJ ÷ 2 = +98 kJ
ب) آب ترکیب پای دارتری نسبت به آب اکسیژنه است، به همین جهت از ترکیب گازهای هیدروژن و اکسیژن آب حاصل می شود و نمی توان آب اکسیژنه را از ترکیب این دو گاز بدست آورد.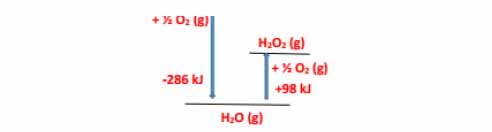
2) واکنش اول را در دو ضرب می کنیم و با عکس واکنش دوم جمع می کنیم
2CO (g) + O2 (g) → 2CO2 (g) ∆H = 2(-283 kJ) = -566 kJ
2NO (g) → N2 (g) + O2 (g) ∆H = -181 kJ
در نتیجه داریم:
2CO (g) + 2NO (g) → 2CO2 (g) + N2 (g) ∆H = -474 kJ
3) الف) گاز CO2 پایدارتر از گاز CO است به همین جهت از واکنش گرافیت با گاز اکسیژن محصول پایدارتر کربن دی اکسید حاصل می شود
ب) طبق قانون هس :
∆H = ∆H1 + ∆H2
-393.5 = -283 + ∆H1
∆H1 = -393.5 + 283 = -110.5 kJ
4) الف) آمونیاک پایدارتر از هیدرازین است. زیرا محتوای انرژی آن پایین تر از هیدرازین است.
ب)
N2 (g) + 3H2 (g) → 2NH3 (g) ∆H = -92 kJ
2NH3 (g) → N2H4 (g) + H2 (g) ∆H = -183 kJ
طبق قانون هس
∆H = (-∆H1) + ∆H2
∆H = -92 + (-(-183)) = 91 kJ
مای درس ، برترین اپلیکیشن کمک درسی ایران
پوشش تمام محتواهای درسی پایه چهارم تا دوازدهم- آزمون آنلاین تمامی دروس
- گام به گام تمامی دروس
- ویدئو های آموزشی تمامی دروس
- گنجینه ای از جزوات و نمونه سوالات تمامی دروس
- فلش کارت های آماده دروس
- گنجینه ای جامع از انشاء های آماده
- آموزش جامع آرایه های ادبی، دستور زبان، قواعد زبان انگلیسی و ... ویژه



1736019749.png)















